把煤作为燃料可通过下列两种途径:
途径I: C(s)+O2(g) ="==" CO2(g)
途径II:先制水煤气: C(s) + H2O(g) ="==" CO(g) + H2(g)
燃烧水煤气:2 CO(g) + O2(g) ="==" 2CO2(g); 2H2(g)+O2(g) ===2H2O(g)
已知:①C(s)+O2(g)===CO2(g);△H1=-393.5kJ·mol-1
②H2(g)+ O2(g)=H2O(g);△H2=-241.8kJ·mol-1
O2(g)=H2O(g);△H2=-241.8kJ·mol-1
③CO(g)+  O2 (g)=CO2(g);△H3=-283.0kJ·mol-1
O2 (g)=CO2(g);△H3=-283.0kJ·mol-1
请回答下列问题:
(1)C(煤)的标准燃烧热是
(2)根据盖斯定律写出煤和气态水生成水煤气的热化学方程式:
(3)在制水煤气反应里,反应物具有的总能量________(填“>”、“<”或“=”)生成物所具有的总能量
(4)根据两种途径,下列说法错误的是 (单选)
| A.途径II制水煤气时增加能耗,故途径II的做法不可取 |
| B.与途径I相比,途径II可以减少对环境的污染 |
| C.与途径I相比,途径II可以提高煤的燃烧效率 |
| D.将煤转化为水煤气后,便于通过管道进行运输 |
一定温度下,将3molA气体和1molB气体通过一密闭容器中,发生如下反应:
3A(g)+B (g) xC(g)。
xC(g)。
请填写下列空白:
(1)若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4mol/L。
①1min内,B的平均反应速率为_________;x=__ _______;
_______;
②若反应经2min达到平衡,平衡时C的浓度_________0.8mol/L(填“大于”、“等于”或“小于”);
③平衡混合物中,C的体积分数为22%,则A的转化率是_________;
④改变起始物质加入的量,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应满足的关系式_________。
(2)若维持容器压强不变 ,达到平衡时C的体积分数_________22%,(填“大于”、“等于”或“小于”)
(16分 )镁可与其他金属构成合金。镁铝合金的强度高,机械性能好。有“国防金属”的美誉。自然界中的镁元素主要存在于海水中。海水中镁的总储量约为1.8×1015t。从海水中(主要含含Na+,Cl—,Mg2+等离子)提取镁的工艺流程图如下:
)镁可与其他金属构成合金。镁铝合金的强度高,机械性能好。有“国防金属”的美誉。自然界中的镁元素主要存在于海水中。海水中镁的总储量约为1.8×1015t。从海水中(主要含含Na+,Cl—,Mg2+等离子)提取镁的工艺流程图如下:
(1)A物质的化学式为。操作1的名称为。
(2)试写出向固体A中加入足量盐酸的离子方程式。
(3)该反应的副产物主要有等。
(4)若开始得到的固体A的质量为116g,不考虑物质的损失,则最后生成的Mg的物质的量为mol。
Ⅰ.糕点等食品包装入一个类似干燥剂的小袋――脱氧剂。其作用是吸收氧气,使食物因缺氧而不变质、发霉等,从而长期保存食品。铁脱氧剂就是利用铁易被氧化的性质来吸收氧气,最终产物是Fe2O3∙3H2O。有关反应如下:
①2Fe+O2+2H2O==2Fe(OH)2②4Fe(OH)2+O2+2H2O==4Fe(OH)3
③2Fe(OH)3==Fe2O3∙3H2O
(1)以上反应中,属于氧化还原反应的是(填编号);
(2)反应②中的还原剂是(填化学式)。
Ⅱ.黑火药是由硫黄粉、 硝酸钾和木炭按一定比例混合而成的,爆炸时的反应是:
硝酸钾和木炭按一定比例混合而成的,爆炸时的反应是:
S + 2KNO3 + 3C = K2S+ M + 3CO2↑(已配平)
(1)生成物M的化学式为;
(2)在此反应中的还原剂为。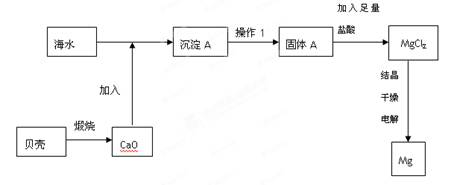
在碱性废水的处理中,通常用于烟道气处理。在充分燃烧的烟道中,大约含有14%的CO2,将烟道气通入碱性废水中进行中和处理,是比较先进而经济的办法,写出该处理方法的离子方程式。
把下列离子方程式改写成化学方程式
(1)CO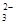 +2H+
+2H+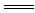 CO2↑+H2O
CO2↑+H2O
(2)Ag++Cl-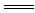 AgCl↓
AgCl↓
(3)Cu2++2OH-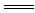 Cu(OH)2↓
Cu(OH)2↓
(4)Ba2+十SO42-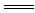 BaSO4
BaSO4 ↓
↓