25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:
Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。下列判断正确的是
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。下列判断正确的是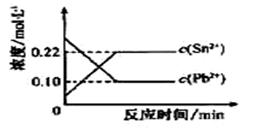
| A.往平衡体系中加入金属铅后,c(Pb2+)增大 |
| B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变大 |
| C.升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0 |
| D.25℃时,该反应的平衡常数K=0.225. |
从下列事实所列出的相应结论正确的是()
| 实验事实 |
结论 |
|
| A |
Cl2的水溶液可以导电 |
Cl2是电解质 |
| B |
SO2通入硝酸钡溶液出现白色沉淀 |
BaSO3不溶于强酸 |
| C |
NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 |
酸性:HCO3->Al(OH)3 |
| D |
SO2通入KMnO4溶液,溶液褪色 |
SO2具有漂白性 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是()
| A.0.1molCnH2n+2中含有的C-C键数为0.1NA |
| B.6.9g钠与足量的CO2和H2O(g)混合气体充分反应,转移的电子数一定为0.3NA |
| C.0.1mol/L的氯化铝溶液中含有的氯离子数为0.3NA |
| D.标准状况下,2.24L氯仿中含有C-Cl键数为0.3NA |
在配制一定物质的量浓度的盐酸时,下列操作可使所配溶液浓度偏高的是()
| A.用量筒量取浓盐酸时俯视读数 |
| B.溶解搅拌时有液体飞溅 |
| C.定容时俯视容量瓶瓶颈刻度线 |
| D.摇匀后见液面下降,再加水至刻度线 |
下列离子方程式中,不正确的是()
| A.用碳棒作电极电解硫酸铜溶液: 2Cu2+ + 2H2O =" 2Cu" + O2↑+ 4H+ |
| B.在硫酸氢钾溶液中加入氢氧化钡溶液至中性 : Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
| C.向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全: 2Al3++ 3SO42-+ 3Ba2++ 6OH-=2Al(OH)3↓+ 3BaSO4↓ |
| D.硫酸亚铁的酸性溶液中加入H2O2溶液: |
2Fe2++H2O2+2H+=2 Fe3++2H2O
下列大小顺序排列完全正确的组合是()
①气态氢化物的稳定性:HF>NH3>PH3
②熔点:Na>C3H8>CH3OH
③离子半径:K+>Ca2+>S2—
④相同温度、相同浓度的溶液中水的电离程度:NH4Cl>CH3COOH>HCl
| A.①④ | B.①② | C.②③ | D.③④ |