以石墨电极电解200 mL CuSO4溶液,电解过程中产生气体体积V(g)(标准状况)与电子转移物质的量n(e-)的关系如下图所示,n(e-)=0.8 mol时停止电解。下列说法中正确的是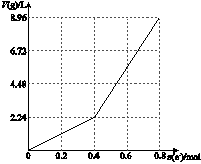
| A.电解前CuSO4溶液的物质的量浓度为2 mol/L |
| B.当n(e-)=0.6 mol时,V(H2)∶V(O2)=2∶3 |
| C.电解后所得溶液中c(H+)=2 mol/L |
| D.向电解后的溶液中加入16 g CuO,则溶液可恢复为电解前的浓度 |
X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是
| A.由mXa+与nYb-,得m+a=n-b |
| B.X2-的还原性一定大于Y- |
| C.X,Y一定不是同周期元素 |
| D.若X的原子半径大于Y,则气态氢化物的稳定性HmX一定大于HnY |
下列溶液中微粒浓度关系一定正确的是( )
| A.均为0.10mol·L-1 NH4Cl和NH4HSO4溶液,c(NH4+)前者小于后者 |
| B.25℃时NH4Cl溶液的KW大于100℃时NH4Cl溶液的KW |
| C.25℃时pH=11的NaOH和pH=11的氨水分别稀释100倍后的pH前者一定大于后者 |
| D.25℃时,pH=4的盐酸与pH=10的氨水溶液等体积混合后pH< 7 |
常温,下列各组离子在指定溶液中能大量共存的是( )
| A.pH=1的溶液中: I-、NO3-、SO42-、Na+ |
| B.由水电离的c(H+)=1×10-14 mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3- |
| C.c(H+)/c(OH-)=1012的溶液中: NH4+、Al3+、NO3-、Cl- |
| D.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN- |
ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。实验室中可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4= 2ClO2↑+K2SO4+2CO2↑+2H2O下列说法不正确的是( )
| A.CO2是氧化产物 | B.H2C2O4在反应中被氧化 |
| C.1mol KClO3参加反应,转移的电子为1mol | D.H2C2O4的氧化性强于ClO2的氧化性 |
下列说法正确的是()
| A.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 |
| B.蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 |
| C.Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到 |
| D.天然气、乙醇和水煤气分别属于化石能源、不可再生能源和二次能源 |