N2H4是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程式中正确的是( )
| A.1/2 N2H4(g)+1/2O2(g)==="1/2" N2(g)+H2O(g)ΔH=+267 kJ·mol-1 |
| B.N2H4(g)+O2(g)===N2(g)+2H2O(l)ΔH=-133.5 kJ·mol-1 |
| C.N2H4(g)+O2(g)===N2(g)+2H2O(g)ΔH=+534 kJ·mol-1 |
| D.N2H4(g)+O2(g)===N2(g)+2H2O(g)ΔH=-534 kJ·mol-1 |
下列说法正确的是
| A.需加热才能发生的反应一定是吸热反应 |
| B.任何放热反应在常温条件一定能发生反应 |
| C.反应物和生成物分别具有的总能量决定了反应是放热反应还是吸热反应 |
| D.当△H<0时表明反应为吸热反应 |
下列叙述正确的是
| A.NaHCO3溶液中:c(H+) + c(Na+)=c(HCO3-)+2c(CO32-) + c(OH-) |
| B.pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(H+)一样多 |
| C.0.2mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH=1 |
| D.向10 mL 0.10mol•L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
在容积不变的密闭容器中加入1 mol N2和3 mol H2发生反应,下列叙述正确的是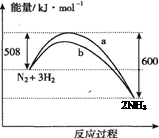
A.该反应的热化学方程式为:N2 + 3H2 2NH3ΔH =-92 kJ/mol 2NH3ΔH =-92 kJ/mol |
| B.达到平衡后向容器中通入1 mol氦气,平衡不移动 |
| C.曲线b表示可能使用了催化剂 |
| D.降低温度和缩小容器体积均可使该反应平衡常数增大 |
下列电离或离子方程式正确的是
A.亚硫酸的电离:H2SO3 2H++ SO3 2H++ SO3 |
B.氯化铵水解的离子方程式为:NH4+ +H2O  NH3·H2O + H+ NH3·H2O + H+ |
C.NaHCO3水解的离子方程式为:HCO3-+H2O CO3 CO3 +H3O+ +H3O+ |
D.向氯化铝溶液中加入过量的氨水:A1 +3NH3·H2O= Al(OH)3↓+3NH4+ +3NH3·H2O= Al(OH)3↓+3NH4+ |
某温度下,体积一定的密闭容器中进行可逆反应:X(g)+Y(g) Z(g)+W(s) ΔH > 0,
Z(g)+W(s) ΔH > 0,
下列叙述正确的是
| A.加入少量W,逆反应速率增大 |
| B.当容器中气体密度不变时,反应达到平衡 |
| C.升高温度,Y的百分含量减少 |
| D.平衡后加入X,上述反应的ΔH增大 |