下列叙述正确的是
| A.分子晶体中的每个分子内一定含有共价键 |
B.原子晶体中的相邻原子间只存在非极性共价键 |
C.离子晶体中可能含有共价键 |
D.分子晶体的熔沸点很低,常温下都呈液态或气态 |
某元素X的气态氢化物的化学式为H2X,则X的最高价氧化物的水化物的化学式是( )
| A.HXO3 | B.H2XO3 | C.H2XO4 | D.H3XO4 |
下列实验中,不能观察到明显变化的是( )
| A.把一小段打磨过的铝片放入少量冷水中 | B.把氯气通入FeCl2溶液中 |
| C.把绿豆大的钾投入盛在大烧杯内的水中 | D.把溴水滴加到KI淀粉溶液中 |
下列物质中,只含有极性键的是( )
| A.NaOH | B.Na2O2 | C.H2O2 | D.HClO |
放射性同位素钬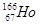 的原子核内的中子数与核外电子数之差是( )
的原子核内的中子数与核外电子数之差是( )
| A.32 | B.67 | C.99 | D.166 |
根据元素周期表和元素周期律分析,下列推断中错误的是( )
| A.铍的原子失去电子能力比镁弱 | B.砹的氢化物不稳定 |
| C.硒化氢比硫化氢稳定 | D.氢氧化锶比氢氧化钙的碱性强 |