近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n。已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高。Al2H6球棍模型如下图。下列有关说法肯定错误的是
| A.Al2H6在固态时所形成的晶体是分子晶体 |
| B.氢铝化合物可能成为未来的储氢材料和火箭燃料 |
| C.Al2H6在空气中完全燃烧,产物为氧化铝和水 |
| D.Al2H6中含有离子键和极性共价键 |
下列反应中,不是氧化还原反应的是
①H2+Cl2 2HCl ②Na2CO3+2HCl═2NaCl+H2O+CO2↑
2HCl ②Na2CO3+2HCl═2NaCl+H2O+CO2↑
③2H2O 2H2↑+O2↑④CuO+2HNO3═Cu(NO3)2+H2O
2H2↑+O2↑④CuO+2HNO3═Cu(NO3)2+H2O
⑤2HgO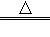 2Hg+O2↑
2Hg+O2↑
| A.②④ | B.①③ | C.①②③ | D.④⑤ |
下列说法正确的是
| A.蒸馏时,通入冷凝管的水从其上口流进,下口流出 |
| B.一束平行光照射CuSO4溶液时,从侧面可看到光亮的通路 |
| C.电解质溶液导电的原因是因为有自由移动的离子 |
| D.将饱和的FeCl3溶液滴入沸腾的NaOH溶液中可制得氢氧化铁胶体 |
配制250 mL、0.10 mol·L-1的NaOH溶液时,下列实验操作会使配得的溶液中NaOH物质的量浓度偏大的是
| A.转移溶液后未洗涤烧杯和玻璃棒就直接定容 |
| B.在容量瓶中进行定容时仰视刻度线 |
| C.在容量瓶中进行定容时俯视刻度线 |
| D.定容后把容量瓶倒置摇匀,发现液面低于刻度线,又补足了所缺的水 |
下列离子反应方程式正确的是
| A.硫酸铝与氨水反应:Al3++3OH-=Al(OH)3 ↓ |
| B.碳酸钙溶于醋酸:CaCO3+2H+ =Ca2++H2O+CO2 ↑ |
| C.CO2与水的反应:CO2 + H2O = 2H++ CO32- |
| D.NaHCO3溶液中加入盐酸:H++HCO3-= CO2↑+H2O |
在无色透明的强酸性溶液中,能大量共存的离子组是
| A.K+、SO42﹣、CO32﹣、Na+ |
| B.Ca2+、NO3﹣、Al3+、Cl﹣ |
| C.Fe3+、Cu2+、K+、OH﹣ |
| D.MnO4﹣、K+、SO42﹣、Na+ |