碱性锌锰电池的总反应是:Zn + 2MnO2 + 2H2O =" 2MnOOH" + Zn(OH)2,电解质是KOH。下列说法正确的是
| A.MnO2发生了氧化反应 |
| B.MnOOH中Mn元素的化合价为+3 |
| C.反应消耗 0.65gZn,有0.01 mol电子发生转移 |
| D.电池正极的反应为:Zn + 2 OH-–2e-===Zn(OH)2 |
水的电离平衡曲线如图所示,下列说法不正确的是
| A.图中四点Kw间的关系:A=D<C<B |
| B.若从A点到C点,可采用:温度不变在水中加入少量NaAc固体 |
| C.若从A点到D点,可采用:温度不变在水中加入少量酸 |
| D.若处在B点所在的温度,将pH=2的硫酸与pH=10的NaOH的两种溶液等体积混合后,溶液显中性 |
在下列各组反应中,两者反应遵循的化学原理相同的是
| A.KClO3+6HClKCl+3Cl2↑+3H2O和2Na2S+3H2SO3===2Na2SO3+3S↓+3H2O |
| B.稀硫酸溶解FeO和稀硝酸溶解FeO |
| C.过氧化钠的漂白性和SO2水溶液的漂白性 |
| D.泡沫灭火器灭火和干粉灭火器灭火 |
与pH类似,我们定义pOH=-lgc(OH-),下列溶液,一定呈中性的是
| A.c(H+)=1×10-7mol·L-1的溶液 |
| B.水电离的H+和OH-浓度相等的溶液 |
| C.pH+pOH=14的溶液 |
| D.pH=pOH的溶液 |
在密闭容器中进行以下可逆反应:A(g)+B(g) C(g)+2D(?),在不同的条件下C的百分含量的变化情况如右图,则该反应描述正确的是
C(g)+2D(?),在不同的条件下C的百分含量的变化情况如右图,则该反应描述正确的是
| A.正反应放热,D是固体 |
| B.正反应放热,D是气体 |
| C.正反应吸热,D是气体 |
| D.正反应放热,D是固体或气体 |
如图是关于N2+3H2 2NH3 ΔH<0的速率—时间图象,则t1时刻使平衡发生移动的原因是
2NH3 ΔH<0的速率—时间图象,则t1时刻使平衡发生移动的原因是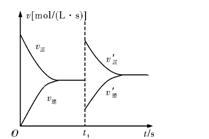
| A.升高温度,同时增大压强 |
| B.降低温度,同时减小压强 |
| C.增大反应物的浓度,同时使用适宜的催化剂 |
| D.增大反应物的浓度,同时减小生成物的浓度 |