分析如下残缺的反应:RO3— + + 6H+=3R2↑+3H2O,下列叙述正确的是
| A.上式中缺项所填物质在反应中作氧化剂 |
| B.RO3—中的R元素在所有的反应中只能被还原 |
| C.R的原子半径在同周期元素原子中最小 |
| D.R一定是周期表中的第ⅤA族元素 |
下列离子方程式中,只能表示一个化学反应的是()
① CO32-+2H+=CO2↑+H2O
② Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
③ Ag++Cl-=AgCl↓④ Fe+Cu2+=Fe2++Cu
⑤ Cl2+H2O=H++Cl-+ HClO
| A.①③ | B.②④ | C.②⑤ | D.只有⑤ |
下列实验操作中一定会造成实验值偏小的是()
| A.将pH试纸用蒸馏水湿润后测某溶液的pH |
| B.配制500mL0.01mol/L NaCl溶液,定容时仰视 |
| C.测定胆矾结晶水含量的实验中,加热粉末至有黑色物质生成 |
D.使用天平称量时不小心将药品与砝 码的位置放反了 码的位置放反了 |
往FeCl3和BaCl2的混合溶液中通入SO2,溶液颜色由棕黄色变成浅绿色,同时产生白色沉淀。下列有关说法中不正确的是()
| A.白色沉淀为BaSO4 | B.反应后溶液的pH减小 |
| C.此实验表明SO2有漂白性 | D.此实验中Fe3+表现出氧化性 |
下列说法正确的是()
A.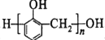 的合成单体有CH3OH 的合成单体有CH3OH |
| B.C4H8属于链烃的同分异构体只有2种 |
| C.由氨基酸合成蛋白质主要进行的是加聚反应 |
D.右图有机物的命名为:3,3,4—三甲基己烷 |