一定条件下,在密闭容器中,能表示反应X(g)+2Y(g)  2Z(g) 一定达到化学平衡状态的是:① X、Y、Z的物质的量之比为1:2:2 ② X、Y、Z的浓度不再发生变化 ③ 容器中的压强不再发生变化 ④ 单位时间内生成n mol Z,同时生成2n mol Y
2Z(g) 一定达到化学平衡状态的是:① X、Y、Z的物质的量之比为1:2:2 ② X、Y、Z的浓度不再发生变化 ③ 容器中的压强不再发生变化 ④ 单位时间内生成n mol Z,同时生成2n mol Y
| A.①② | B.①④ | C.②③ | D.③④ |
下列物质性质与应用对应关系正确的是
| A. | 晶体硅熔点高硬度大,可用于制作半导体材料 |
| B. | 氢氧化铝具有弱碱性,可用于制胃酸中和剂 |
| C. | 漂白粉在空气中不稳定,可用于漂白纸张 |
| D. | 氧化铁能与酸反应,可用于制作红色涂料 |
25 时,下列各组离子在指定溶液中一定能大量共存的是
| A. | =1的溶液中: 、 、 、 |
| B. | =1×10 -13 的溶液中: 、 、 、 |
| C. | 0.1 溶液中: 、 、 、 |
| D. | 0.1 溶液中: 、 、 、 |
下列关于化学用语的表示正确的是
| A. | 过氧化钠的电子式:  |
| B. | 质子数为35、中子数为45的溴原子: |
| C. | 硫离子的结构示意图: 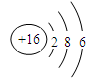 |
| D. | 间二甲苯的结构简式:  |
水是生命之源,2014年我国科学家首次拍摄到水分子团簇的空间取向图像,模型如图。下列关于水的说法正确的是
| A. | 水是弱电解质 | B. | 可燃冰是可以燃烧的水 |
| C. | 氢氧两种元素只能组成水 | D. | 0℃时冰的密度比液态水的密度大 |
将 放入密闭的真空容器中,反应 达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是()
| A. |
平衡常数减小 |
B. |
量不变 |
C. |
氧气压强不变 |
D. |
量增加 |