碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为: Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s) 则下列说法错误的是
| A.电池工作时,锌失去电子,电极反应式为:Zn +2OH-—2e- = Zn(OH)2(s) |
| B.电池正极的电极反应式为:2MnO2(s) + H2O(l) +2e-=Mn2O3(s)+2OH-(aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g |
在下列变化①大气通过闪电固氮②硝酸分解③实验室用氯化铵和消石灰制取氨气④二氧化氮溶于水中,按氮元素被还原、被氧化、既被氧化又被还原、既不被氧化又不被还原的顺序排列,正确的是
| A.②①④③ | B.①②③④ | C.②④①③ | D.①③④② |
将一小块金属钠投入过量的硫酸铜溶液中,主要生成物是
| A. Na2SO4和Cu | B. NaOH和H2 |
| C. Cu(OH)2和H2 | D. Na2SO4、Cu(OH)2和H2 |
下列物质的分类合理的是
下图装置可用于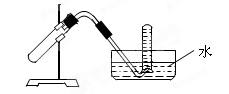
| A.加热NaHCO3固体制CO2 |
| B.Cu和稀HNO3反应制NO |
| C.NH4Cl与浓Ca(OH)2溶液反应制NH3 |
| D.Cu和浓HNO3反应制NO2 |
下列关于NaHCO3和Na2CO3的叙述不正确的是
| A.NaHCO3比Na2CO3稳定 |
| B.NaHCO3、Na2CO3可相互转化 |
| C.NaHCO3可用于焙制糕点;Na2CO3可用于玻璃、造纸等工业 |
| D.都能与澄清石灰水反应生成白色沉淀 |