阿斯匹林(乙酰水杨酸) 是一种常用的退热、镇痛药物,临床常用于预防心血管疾病。阿斯匹林对肠胃有一定的副作用,患有消化系统疾病的人不宜服用。则下列对此化合物说法不正确的是 ( )
是一种常用的退热、镇痛药物,临床常用于预防心血管疾病。阿斯匹林对肠胃有一定的副作用,患有消化系统疾病的人不宜服用。则下列对此化合物说法不正确的是 ( )
| A.阿斯匹林能与NaHCO3反应,最多能与3mol H2发生加成反应 |
| B.1 mol阿斯匹林与足量的NaOH溶液反应,消耗NaOH最大的物质的量为3 mol |
| C.其苯环上的一氯取代物有两种 |
D.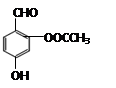 与阿斯匹林互为同分异构体,该有机物遇FeCl 3溶液显紫色 与阿斯匹林互为同分异构体,该有机物遇FeCl 3溶液显紫色 |
下列各项叙述I、Ⅱ都正确且二者的原理最相似的是
| 叙述I |
叙述Ⅱ |
|
| A |
FeS难溶于水,却溶于稀硝酸 |
CaCO3难溶于稀硫酸,却溶于醋酸 |
| B |
浓硝酸要密封保存阴凉处 |
漂白粉要密封保存在阴凉处 |
| C |
盐酸与铁反应生成氯化亚铁 |
少量氯气与铁反应生成氯化亚铁 |
| D |
碳酸钠溶液显弱碱性 |
氯化铵溶液显弱酸性 |
已知N2(g)+3H2(g) 2NH3(g)△H=— 92.4kJ•mo1—1,下列结论正确的是
2NH3(g)△H=— 92.4kJ•mo1—1,下列结论正确的是
| A.在密闭容器中加入1mol N2和3mol H2充分反应放热92.4kJ |
B.N2(g)+3H2(g) 2NH3(l)△H=— QkJ•mo1—1,则Q>92.4 2NH3(l)△H=— QkJ•mo1—1,则Q>92.4 |
| C.增大压强,平衡向右移动,平衡常数增大 |
| D.若一定条件下反应达到平衡,N2的转化率为20%,则H2的转化率一定为60% |
下列叙述正确的是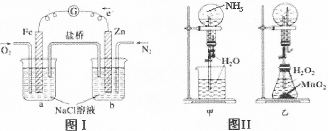
| A.图I装置中通入N2和O2的作用是相同的 |
| B.图Ⅱ中甲、乙两装置产生喷泉的原理一样 |
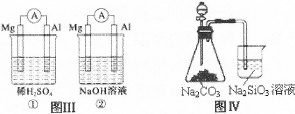
| C.图Ⅲ①装置中镁片是原电池的负极;②装置中镁片是原电池的正极 |
| D.图Ⅳ分液漏斗盛硝酸能证明非金属性N>C>Si,盛硫酸能证明非金属性S>C>Si |
水溶液中能大量共存的一组离子是
| A.Al3+、Cl—、A1O2—、SiO32— |
| B.H+、Na+、S2—、ClO— |
| C.K+、Mg2+、SO42—、MnO4ˉ |
| D.Fe3+、Ca2+、SCN—、NO3— |
设nA为阿伏加德罗常数的数值,下列说法正确的是
| A.铁与足量稀硝酸反应,1mo1Fe失去电子数为3nA |
| B.常温常压下,22.4L乙烯中含极性共价键数目为5nA |
| C.1L1mol•L—1的NH4Cl溶液中有nA个NH4+ |
| D.1mol冰醋酸和lmo1乙醇在浓硫酸加热下充分反应生成H2O个数为nA |