X、Y、Z、R、W是5种短周期元素,原子序数依次增大;它们可组成离子化合物Z2Y和共价化合物RY3、XW4;已知Y、R同主族, Z、R 、W同周期。下列说法错误的是( )
| A.原子半径:Z>R>W |
| B.气态氢化物稳定性:HmW>HnR |
| C.XW4分子中各原子均满足8电子结构 |
| D.Y、Z、R三种元素组成的化合物水溶液一定显碱性 |
化学工作者一直关注食品安全,发现有人将工业染料“苏丹红1号”非法用作食用色素.苏丹红是一系列人工合成染料,其中“苏丹红4号”的结构式如下: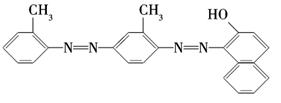
下列关于“苏丹红4号”说法正确的是 ( )
| A.不能发生加成反应 | B.属于芳香烃 |
| C.可以使高锰酸钾酸性溶液褪色 | D.属于甲苯的同系物 |
一种从植物中提取的天然化合物αdamascone可用于制作“香水”,
其结构为: ,有关该化合物的下列说法不正确的是( )
,有关该化合物的下列说法不正确的是( )
| A.分子式为C13H20O |
| B.该化合物可发生聚合反应 |
| C.1mol该化合物完全燃烧消耗19 mol O2 |
| D.与溴的CCl4溶液反应生成的产物经水解、稀硝酸酸化后可用AgNO3溶液检验 |
下列说法或表示方法正确的是 ( )
A.乙烯的结构简式CH2CH2
B.化学名词:乙酸乙酯、笨、坩锅
D.聚乙烯的化学式为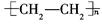
分子式为C4H8的烯烃 (要考虑顺反异构体) 的同分异构体共有 ( )
| A.4种 | B.5种 | C.6种 | D.7种 |
下列关于有机化合物的说法正确的是( )
| A.乙醇和乙酸都存在碳氧双键 |
| B.甲烷和乙烯都可以与氯气反应 |
| C.高锰酸钾可以氧化苯和甲烷 |
| D.乙烯可以与氢气发生加成反应,苯不能与氢气加成 |