在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有
| A.滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、I- |
| B.pH值为1的溶液:Cu2+、Na+、Mg2+、NO3- |
| C.水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Al3+ |
| D.能与铝反应产生H2的溶液:K+、Ba2+、NO3-、Al3+ |
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是
| A.第一电离能Y可能小于X |
| B.气态氢化物的稳定性:HmY大于HnX |
| C.最高价含氧酸的酸性:X对应的酸性强于Y对应的 |
| D.X和Y形成化合物时,X显负价,Y显正价 |
据权威刊物报道,1996年科学家在宇宙中发现H3分子。甲、乙、丙、丁四位学生对此报道的认识正确的是
| A.甲认为上述发现绝对不可能,因为H3分子违背了共价键理论 |
| B.乙认为宇宙中还可能存在另一种氢单质,因为氢元素有三种同位素必然有三种同素异形体 |
| C.丙认为H3分子实质上是H2分子与H+以特殊共价键结合的产物,应写成H |
| D.丁认为如果上述的发现存在,则证明传统的价键理论有一定的局限性有待继续发展 |
下列说法中正确的是
| A.在气体单质分子中,一定含有σ键,可能含有π键 |
| B.烯烃比烷烃的化学性质活泼是由于烷烃中只含σ键而烯烃含有π键 |
| C.等电子体结构相似,化学性质相同 |
| D.共价键的方向性决定了原子在形成分子时相互结合的数量关系 |
气态中性基态原子的原子核外电子排布发生如下变化,吸收能量最多的是
| A.1s22s22p63s23p2→1s22s22p63s23p1 |
| B.1s22s22p63s23p3→1s22s22p63s23p2 |
| C.1s22s22p63s23p4→1s22s22p63s23p3 |
| D.1s22s22p63s23p63d104s24p2→1s22s22p63s23p63d104s24p1 |
下列表达方式错误的是
A.CO2分子的比例模型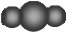 |
B.甲烷的电子式 |
| C.硫离子的核外电子排布式1s22s22p63s23p4 | D.HClO的结构式:H-O-Cl |