在恒温恒容条件下,向容积为2L的密闭容器中充入2.0molSO2和2.0molO2。已知:2SO2(g)+O2(g) 2SO3(g) ∆H=-akJ/mol(a>0),经2min达到平衡状态,反应放热0.25akJ。下列判断正确的是
2SO3(g) ∆H=-akJ/mol(a>0),经2min达到平衡状态,反应放热0.25akJ。下列判断正确的是
| A.在1min时:c(SO3)+c(SO2)="1.0" mol·L-1 |
| B.在2min内:v(SO2)="0.25" mol·L-1·min-1 |
| C.若再充入2molSO3,达到平衡时SO3的质量分数减小 |
| D.反应条件相同,若起始时向反应容器充入2molSO3,达到平衡时反应吸热0.75 akJ |
用NA表示阿伏加德罗常数,下列叙述不正确的是( )
| A.标准状况下,22.4L H2含有的分子数为1 NA |
| B.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA |
| C.常温常压下,48g O3所含的氧原子数为3NA |
| D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1 NA |
氯化铁溶液与氢氧化铁胶体具有的共同性质是()
| A.分散质颗粒直径都小于l nm | B.能透过半透膜 |
C.加热蒸干、灼烧后都有氧化铁生 成 成 |
D.呈红褐色 |
航天科学技术测得,三氧化二碳(C2O3)是金星大气层的成分之一。下列有关C2O3的说法不正确的是()
| A.C2O3和CO2都属于非金属氧化物 |
| B.C2O3和CO的燃烧产物都是CO2 |
| C.C2O3和CO都是酸性氧化物 |
| D.C2O3和CO都具有还原性 |
下图分别表示四种操作,其中有两处错误的是 ()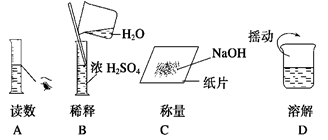
将0.05mol下列物质置于500mL水中,充分搅拌后,溶液中阴离子数目最多的是:
A.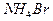 |
B.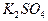 |
C.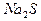 |
D.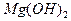 |