化学键的键能是指气态原子间形成1mol化学键时释放的能量。如:H(g)+I(g)→H-I(g)+297KJ 即H-I键的键能为297kJ/mol,也可以理解为破坏1mol H-I键需要吸收297KJ的热量。化学反应的发生可以看成旧化学键的破坏和新化学键的形成。下表是一些键能数据。(单位:kJ/mol)
| |
键能 |
|
键能 |
|
键能 |
| H-H |
436 |
Cl-Cl |
243 |
H-Cl |
432 |
| S=S |
255 |
H-S |
339 |
C-F |
427 |
| C-Cl |
330 |
C-I |
218 |
H-F |
565 |
| C-O |
347 |
H-O |
464 |
Si—Si |
176 |
| Si—O |
460 |
O=O |
497 |
|
|
阅读上述信息,回答下列问题:
(1)根据表中数据判断CCl4的稳定性 (填“大于”或“小于”)CF4的稳定性。试预测C-Br键的键能范围_________< C-Br键能 <__________
(2)有人认为:H-O键的键能大于H-S键的键能,所以H2O的熔沸点高于H2S的熔沸点。你是否赞同这种观点?如不赞同,请说出你的解释。
(3)已知H2O(l)=H2O(g) ΔH=+44kJ/mol,请写出表示氢气燃烧热的热化学方程式:
某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路,发生反应的化学方程式为: ①取少量废液,滴加KSCN溶液显红色.②取10mL废液,加入足量的AgNO3溶液,析出沉淀8.61g.③另取10mL废液,加入一定质量的铜片,充分反应后,测得铜片的质量减少了0.256g,再向反应后的溶液中滴加KSCN溶液不变色.根据探究实验得出结论:
(1)废液中含有的金属离子是。
(2)求10mL废液中氯离子的物质的量浓度?
(3)求10mL废液中铜离子的物质的量是 ?
有关物质间转化关系如下图,试回答:
(1)转化①的反应条件为.
(2)转化②的化学方程式为.转化③的离子方程式为.
(3)若转化⑤用于实验室制Al(OH)3,则试剂A宜选择(填名称).
(4)向50 mL 3 mol·L-1 AlCl3溶液中滴加1 mol·L-1 NaOH溶液,结果Al3+离子有1/3转化为Al(OH) 3沉淀,则加入的NaOH溶液的体积可能为mL。
根据下列转化关系以及现象回答:
(1)固体X的名称是,Y的化学式是。
(2)写出反应l的化学方程式。
(3)写出反应2的化学方程式。
(4)若15.6g X和足量水反应,转移mol e-。
实验室欲配制100 mL、1mol/L的NaCl溶液,请回答:
(1)不需要使用的仪器是。
A、烧杯B、500 mL容量瓶C、量筒 D、胶头滴管 E、玻璃棒 F、100 mL容量瓶
(2)配制时用托盘天平应称取NaClg。
(3)配制溶液的操作顺序是(用字母表示) 。
A、称量 B、洗涤 C、定容 D、溶解 E、摇匀 F、转移
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下: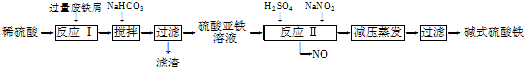
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)反应Ⅰ中发生的氧化还原反应的化学方程式为。
(2)加入少量NaHCO3的目的是调节pH,使溶液中的________(填“Fe3+”、“Fe2+”或“Al3+”)沉淀。该工艺流程中“搅拌”的作用是______________________。
(3)反应Ⅱ的离子方程式为___。在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作________。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为________。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为____________________________。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为________(填字母)。
A. 氯水 B. KSCN溶液 C. NaOH溶液 D. 酸性KMnO4溶液