反应速率v和反应物浓度的关系是用实验方法测定的,化学反应H2+Cl2=2HCl的反应速率v可表示为v=K[c(H2)]m[c(Cl2)]n,式中K为常数,m、n的值可用下表中的数据确定,
| c(H2)(mol·L-1) |
c(Cl2)(mol·L-1) |
v(mol·L-1·s-1) |
| 1.0 |
1.0 |
1.0K |
| 2.0 |
1.0 |
2.0K |
| 2.0 |
4.0 |
4.0K |
由此可推得m、n的值正确的是( )
A. m=1,n=1 B. m=1/2,n=1/2 C. m=1/2,n=1 D. m=1,n=1/2
反应N2O4(g)  2NO2(g);△H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示。下列说法正确的是()
2NO2(g);△H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示。下列说法正确的是()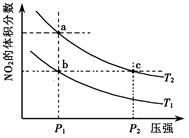
| A.a、c两点的反应速率:a>c |
| B.a、c两点气体的颜色:a浅,c深 |
| C.b、c两点的转化率:b>c |
| D.由b点到a点,可以用加热的方法 |
在恒容密闭容器中存在下列平衡:

 。
。 的平衡物质的量浓度
的平衡物质的量浓度 与温度T的关系如右图所示。下列说法错误的是()
与温度T的关系如右图所示。下列说法错误的是()
A.反应   的 的 |
B.在 时,若反应处于状态 时,若反应处于状态 ,则一定有 ,则一定有 |
C.平衡状态 与 与 相比,平衡状态 相比,平衡状态 的 的 小 小 |
D.若 时的平衡常数分别为 时的平衡常数分别为 ,则 ,则 |
一定条件下,体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g) Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是()
Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是()
| A.以X的反应速率为0.001 mol·L-1·s-1 |
| B.将容器体积变为20 L,Z的平衡浓度变为原来的1/2 |
| C.若增大压强,则物质Y的转化率减小 |
| D.若升高温度,X的体积分数增大,则该反应的ΔH>0 |
下列关于图像及描述说法都正确的是
25℃时,在等体积的① pH=0的H2SO4溶液,②0.05 mol∙L−1的Ba(OH)2溶液,③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是( )
A.1:10:10 :10 :10 |
B.1:5:5×10 :5×10 :5×10 |
C.1:20:10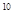 :10 :10 |
D.1:10:10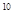 :10 :10 |