【化学-选修2:化学与技术】
水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影响人体健康。请回答下列问题:
(1)天然水中溶解的气体主要有__________、__________。
(2)天然水在净化处理过程中加入的混凝剂可以是 ,其净水作用的原理是_____。
(3)水的净化和软化的区别是__________。
(4)硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO)。若某天然
水中c(Ca2)=1.2×10-3mol/L,c(Mg2+)=6×10-4mol/L,则此水的硬度为
_________。
(5)若(4)中的天然水还含有c(HCO3-)=8×10-4mol/L,现要软化10m3这种天然水,则需先加入Ca(OH)2__________g,后加入Na2CO3___________g。
现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示: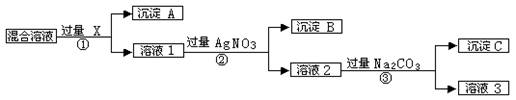
请回答下列问题:
⑴写出实验流程中下列物质的化学式:试剂X:,沉淀A:,沉淀B:。
⑵上述实验流程中加入过量的Na2CO3的目的是。
⑶按此实验方案得到的溶液3中肯定含有杂质(填化学式);为了解决这个问题,可以向溶液3中加入适量的,之后若要获得固体NaNO3需进行的实验操作是(填操作名称)。
A、B、C、D四种化合物,其中A、C、D焰色反应均为黄色,而B的焰色反应为紫色,A、C和盐酸反应均得到D,将固体C加热可得到A,若在A的溶液中通入一种无色无味气 体,又可制得C,若B的溶液滴加到硫酸亚铁溶液会先后出现白色沉淀→灰绿色沉淀→红褐色沉淀E。试推断:
体,又可制得C,若B的溶液滴加到硫酸亚铁溶液会先后出现白色沉淀→灰绿色沉淀→红褐色沉淀E。试推断:
A:、B:、C:_________、D:_________、E:
下列4组物质均有一种物质的类别与其它3种不同,请找出并填在下面空格。
A.CaO、Na2O、CO2、CuO B.C、Na、Mg、Al
C.Na2CO3、FeSO4、Cu(NO3)2、KOH D.H3PO4、H2O、H2SO4、HNO3
以上四组物质中与其他三个不同的物质依次是(填化学式)
A;B;C;D。
在AlCl3溶液中,逐滴滴入NaOH溶液,刚开始可以观察到,写出有关的化学方程式,继续往溶液中滴入NaOH溶液,可以观察到,写出有关的离子方程式。
高分子材料M在光聚合物和金属涂料方面有重要用途,M的结构简式为: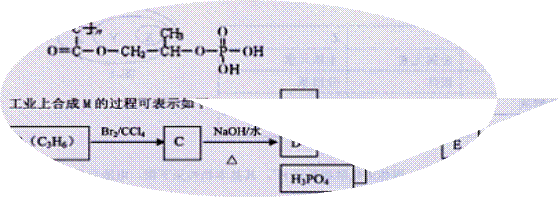
已知:A完全燃烧只生成CO2和H2O,其蒸气密度是相同状况下氢气密度的43倍,分子中H、0原子个数比为3:1。它与Na或Na2CO3都能反应产生无色气体。
(1)A中含有的官能团的名称是 。
(2)下列说法正确的是 (填序号字母)。
a.工业上,B主要通过石油分馏获得
b.C的同分异构体有2种(不包括C)
c.D在水中的溶解性很大,遇新制Cu(OH)2悬浊液,溶液呈绛蓝色
d.E—M的反应是缩聚反应
(3)写出A+D+H3PO4--E反应的化学方程式: ,该反应类型是 。
(4)F是A的一种同分异构体,F的核磁共振氢谱显示分子中有两种不同的氢原子。存在下列转化关系: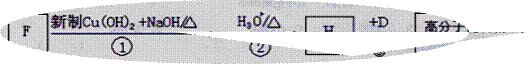
写出F、N的结构简式为:F: N:
写出反应①的化学方程式____