反应4NH3+5O2 4NO+6H2O在5L的密闭容器中进行,30s后,NO的物质的量增加了0.3mol,则此反应的平均速率为
4NO+6H2O在5L的密闭容器中进行,30s后,NO的物质的量增加了0.3mol,则此反应的平均速率为
| A.0.01mol/(L·s) | B.0.008 mol/(L·s) |
| C.0.003mol/(L·s) | D.0.002mol/(L·s) |
下列离子检验的方法中正确的是
| A.向某溶液中滴加硝酸银溶液产生白色沉淀,说明该溶液中存在氯离子 |
| B.向某溶液中滴加氢氧化钠溶液产生蓝色沉淀,说明该溶液中存在铜离子 |
C.向某溶液中滴加氯化钡溶液 产生白色沉淀,说明该溶液中存在硫酸根离子 产生白色沉淀,说明该溶液中存在硫酸根离子 |
| D.向某溶液中滴加稀硫酸生成无色气体,说明该溶液中存在碳酸根离子 |
为了除去粗盐中的Ca2+、Mg2+、SO及泥沙,得到纯净的NaCl,可将粗盐溶于水,然后在下列操作中选取必要的步骤和正确的操作顺序:①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液( )
| A.④②⑤ | B.④①②⑤③ | C.②⑤④①③ | D.①④②⑤③ |
下图所示是分离混合物时常用的仪器,从左至右,可以进行的混合物 分离操作分别是
分离操作分别是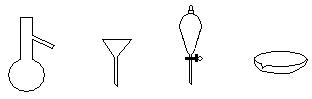
| A.蒸馏、蒸发、萃取、过滤 | B.蒸馏、过滤、萃取、蒸发 |
| C.萃取、过滤、蒸馏、蒸发 | D.过滤、蒸发、萃取、蒸馏 |
在碱性溶液中能大量共存且溶液为无色透明的离子组是
| A.K+、MnO4-、Na+、Cl- | B.K+、Na+、NO3-、CO32- |
| C.Na+、H+、NO3-、SO42- | D.Fe3+、Na+、Cl-、SO42 |
下列离子方程式,书写正确的是
| A.碳酸氢钠溶液中加入足量的澄清石灰水: 2HCO 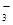 + Ca2++ 2OH-=CaCO3↓+ CO + Ca2++ 2OH-=CaCO3↓+ CO +2H2O +2H2O |
| B.硝酸银溶液中加入铜粉 Ag++Cu===Cu2++Ag |
| C.氧化铜与盐酸反应 O2― +2H+==H2O |
D.碳酸镁跟稀硫酸反应:MgCO3+2H+ Mg2++H2O+CO2↑ Mg2++H2O+CO2↑ |