下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的是
| 元素代号 |
L |
M |
Q |
R |
T |
| 原子半径/nm |
0.160 |
0.143 |
0.089/] |
0.102 |
0.074 |
| 主要化合价 |
+2 |
+3 |
+2/] |
+6、-2 |
-2 |
A.L2+与R2-的核外电子数相等
B.M与T形成的化合物具有两性
C.氢化物的稳定性为H2T<H2R
D.单质与浓度相等的稀盐酸反应的速率为L<Q
某未知溶液中已检验出含有离子Ca2+、NO3-,且pH=2。欲检验此
溶液是否大量存在以下6种离子:
①ClO-②NH4+③Fe3+④I-⑤AlO2-⑥Cl-,其中不必检验就能加以否定的离子是
| A.③⑤⑥ | B.④⑤⑥ | C.①③④ | D.①④⑤ |
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生 气体的体积(V)与时间(t)关系如图。反应中镁和铝的
气体的体积(V)与时间(t)关系如图。反应中镁和铝的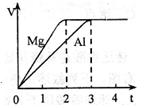

| A.物质的量之比为3:2 | B.质量之比为3:2 |
C.摩尔质量之比为2:3 | D.反应速率之比为2:3 |
化学在生产和日常生活中有着重要的应用。下列说法不正确的是
A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 |
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
C.MgO的熔点很高,可用于制作耐高温材料 |
D.电解MgCl2饱和溶液,可制得金属镁 |
下列各项表述正确的是
A.次氯酸的电子式: |
| B.表示中和热的热化学方程式:NaOH(aq)+HF(aq)=NaF(aq)+H2O(l)△H=-57.3kJ/mol |
C.H2S电离的方程式为:H2S  2H++S2- 2H++S2- |
| D.标准状况下,1.12L16O2和1.12L18O2均含有0.1NA个氧原子 |
设NA表示阿伏加德罗常数的值,下列叙述不正确的是
| A.标准状况下,11.2L三氯甲烷所分子数为0.5NA |
| B.常温常压下,1mol甲基(-CH3)所含电子数为9NA |
| C.常温常压下,22g氧气和26g臭氧混合后,混合气体所含氧原子总数为3NA |
| D.标准状况下,将22.4L的NO2通入足量水中发生反应,转移的电子总数为2/3NA |