类推法是科学学习的重要方法之一。在学习了卤族元素的各种性质后,如下表所示,表格提供的是氧族元素的部分性质。请结合元素周期律完成下列问题:
| 元素 |
8O |
16S |
34Se |
52Te |
| 单质熔点(℃) |
-218.4 |
113 |
x |
450 |
| 单质沸点(℃) |
-183 |
444.6 |
685 |
1390 |
| 主要化合价 |
-2 |
-2,+4,+6 |
-2,+4,+6 |
|
| 原子半径 |
逐渐增大 |
|||
| 单质与H2 反应情况 |
点燃时 易化合 |
加热化合 |
加热难 化合 |
不能直 接化合 |
(1)硒的熔点(x)范围可能是 。
(2)碲的主要化合价可能是 。
(3)在H2O、H2S、H2Se、H2Te四种氢化物中,沸点最低的物质是 ;沸点最高的物质是 。
氧元素与多种元素具有亲和力,所形成化合物的种类很多。
(1)氧元素和过渡元素可形成多种价态的金属氧化物,如和铬可生成Cr2O3、 CrO3、CrO5等。其中CrO5的结构式如图所示,请写出该物质中铬元素的化合价为________,标有“*”的氧原子的化合价为___________。
(2)氧元素可以和氢元素形成原子个数比为1:1的分子,该物质在酸性条件下与Fe2+发生反应的离子方程式为________________________________________________________________________。
(3)氧元素还可以形成多种离子,在NO2+中氮原子轨道杂化类型是。
某学生用浓度为0.1 mol/L左右的KOH溶液滴定未知浓度的盐酸,有如下操作步骤:
(A)移取20.00 mL待测的盐酸注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用KOH溶液润洗滴定管2—3次
(C)把盛有KOH溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取KOH溶液注入碱式滴定管至0刻度以上2—3 cm
(E)调节液面至O或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用KOH溶液滴定至终点,记下滴定管液面的刻度
回答下列问题:
(1)正确操作的顺序是(填编号)
(2)实验室可提供下列浓度的KOH浓液,应选用的是。(填编号)
A.0.1 mol/L B.O.10 m01/L C.O.1032 mol/L
(3)(A)操作中量取待测液的仪器是o
(4)(B)操作的目的是.
(5)(F)操作中判断到达终点的现象是。
(6)(B)如被省略所测结果(填“偏大”、“偏小”、“不变”).
(7)KOH溶液在空气中易变质生成,该物质水溶液PH7,其水溶液中离子浓度大小排序为
(8)(C)步如何使滴定管尖嘴充满溶液
物质A—E都是由下表中的离子组成的,常温下各物质从l mL稀释到1000 mL,pH的变化如图l所示,其中A与D反应得到E。请回答: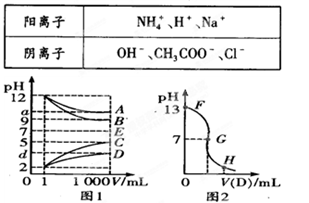
(1)根据图1中各物质的pH变化关系,写出下列物质的化学式:B.,D.。
(2)图l中a>9的理由是。
(3)另取浓度为C1的B溶液25 ml,向其中逐滴滴加0.2 mol/L的D溶液,滴定过程中溶液pH的变化曲线如图2所示。
①C1为 。
②G点溶液呈中性,则加入D溶液的体积V(填“>”、“<’’或“=”)12.5 mL;
③常温下B、C溶液的pH分别是a、b且a+b=13,则将B、C混合恰好完全反应时所消耗B、C溶液的体积比VB:VC=。
在密闭容器中进行反应①Fe(s)+C02(g)  FeO(s)+CO(g) ΔH1=akJ·mol一
FeO(s)+CO(g) ΔH1=akJ·mol一
反应②2CO(g)+02(g)  2C02(g)△H2="b" kJ·mol-
2C02(g)△H2="b" kJ·mol-
反应③2Fe(s)+02(g)  2FeO(s)△H3
2FeO(s)△H3
(1) △H3=(用含a、b的代数式表示)。
(2)反应①的化学平衡常数表达式K=,已知500℃时反应①的平衡常数K=1.0,在此温度下2 L密闭容器中进行反应①,Fe和C02的起始量均为2.0 mol,达到平衡时CO2的转化率为,CO的平衡浓度为。
(3)将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是C02浓度的两倍,则a0(填“>”、“<”或“=”)。为了加快化学反应速率且使体系中CO的物质的量增加,其他条件不变时,可以采取的措施有(填序号)。
A.缩小反应器体积 B.再通入CO2 c.升高温度 D.使用合适的催化剂
(4)下列图像符合反应①的是(填序号)(图中V是速率、φ为混合物中CO含量,T为温度)。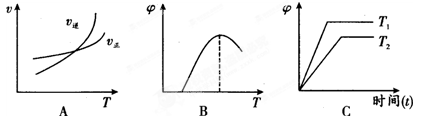
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡: 实验测得不同温度下的平衡数据列于下表:
实验测得不同温度下的平衡数据列于下表:
①可以判断该分解反应已经达到平衡的是。
| A.2v(NH3)=v(C02) | B.密闭容器中总压强不变 |
| C.密闭容器中混合气体的密度不变 | D.密闭容器中氨气的体积分数不变 |
②根据表中数据,列式计算25.0℃时的分解平衡常数:。
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.O℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量(填“增加”“减少”或“不变”)。
④氨基甲酸铵分解反应的焓变AHO(填“>”、“=”或“<”),熵变ASO(填“>”、“=”或“<”)。
(2)已知: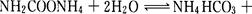
 该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到C(NH2C00-)随时间的变化趋势如图所示。
该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到C(NH2C00-)随时间的变化趋势如图所示。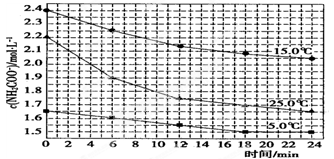
⑤25.O℃时,O~6 min氨基甲酸铵水解反应的平均速率:。
⑥据图中信息,如何说明该水解反应速率随温度升高而增大:。