相同容积的4个密闭容器中进行同样的可逆反应:2A(g)+B(g) 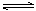 3C(g)+2D(g),保持体积不变。起始时4个容器所装A、B的物质的量分别为:
3C(g)+2D(g),保持体积不变。起始时4个容器所装A、B的物质的量分别为: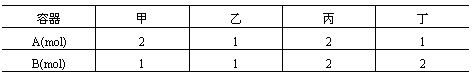
在相同温度下建立平衡时,A或B的转化率大小关系为( )
A.A的转化率为:甲<乙<丙<丁 B.A的转化率为:甲<丙<乙<丁
C.B的转化率为:甲>乙>丙>丁 D.B的转化率为:丁>乙>丙>甲
下列说法中正确的是()
| A.某溶液与NaOH溶液共热,产生能使湿润的蓝色石蕊试纸变红的气体,说明原溶液中存在铵根离子 |
| B.某溶液中加入硝酸银溶液时,产生白色沉淀,加稀硝酸沉淀不溶解,说明原溶液中含Cl- |
| C.用铂丝蘸取某溶液在酒精灯的火焰上灼烧时,火焰呈黄色,说明原溶液中只含有Na+, 不含有K+。 |
| D.某溶液中加入BaCl2溶液时,产生白色沉淀,加稀硝酸沉淀不溶解,说明原溶液中存在SO42- |
选择萃取剂将碘水中的碘萃取出来,这种萃取剂必须具备的性质是()
| A.不溶于水,但比水更易溶解碘 | B.不溶于水,但必须与碘发生反应 |
| C.不溶于水,且密度必须比水的大 | D.不溶于水且密度必须比水小 |
下列溶液中的c(Cl-)与50mL 1mol/L氯化铝溶液中的c(Cl-)相等的是()
| A.150mL 1mol/L氯化钠溶液 | B.75mL 2mol/L 氯化铵溶液 |
| C.150mL 1mol/L氯化钾溶液 | D.75mL 3mol/L氯化钾溶液 |
在含下列离子较多的溶液中,分别加入少量的氢氧化钠固体,不能引起该离子浓度减小的是()
| A.H+ | B.Fe2+ | C.SO42- | D.HCO3- |
配制250mL 0.100mol/L HCl溶液时,下列操作会使配得溶液的物质的量浓度偏大的是()
| A.定容后摇匀,发现液面低于刻度线,再加水至刻度线。 |
| B.移液后未洗涤烧杯 |
| C.在容量瓶中进行定容时,俯视刻度线。 |
| D.容量瓶用0.100mol/L HCl进行润洗 |