恒温、恒压下,1 mol A和n mol B在一个容积可变的容器中发生如下反应:
A(g)+2B(g) 2C(g),一段时间后达到平衡,生成a molC。则下列说法中正确的是( )
2C(g),一段时间后达到平衡,生成a molC。则下列说法中正确的是( )
A.转化的物质A有a mol
B.起始时刻和达平衡时容器中的压强比为(1+n):(1+n - )
)
C.当υ正(A)=2υ逆(C)时,可判断反应达平衡
D.物质B的转化率为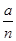
用Pt作电极,电解含c(Cu2+)∶c(Na+)∶c(Cl-)=1∶2∶4的混合溶液,在任何情况下,阴、阳两极下不可能同时发生的反应是( )
A.阴极:2H++2e- H2↑阳极:4OH--4e- H2↑阳极:4OH--4e- 2H2O+O2↑ 2H2O+O2↑ |
B.阴极:2H++2e- H2↑ 阳极:2Cl--2e- H2↑ 阳极:2Cl--2e- Cl2↑ Cl2↑ |
C.阴极:Cu2++2e- Cu阳极:4OH--4e- Cu阳极:4OH--4e- 2H2O+O2↑ 2H2O+O2↑ |
D.阴极:Cu2++2e- Cu 阳极:2Cl--2e- Cu 阳极:2Cl--2e- Cl2↑ Cl2↑ |
已知:H2(g)+ O2(g)
O2(g) H2O(l)ΔH="-285.8" kJ/mol
H2O(l)ΔH="-285.8" kJ/mol
CH4(g)+2O2(g) CO2(g)+2H2O(l)ΔH="-890.3" kJ/mol
CO2(g)+2H2O(l)ΔH="-890.3" kJ/mol
现有H2和CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2(g)和H2O(l),共放出热量3 242.5 kJ,则原混合气体中H2和CH4的物质的量之比是( )
| A.1∶1 | B.1∶3 | C.1∶4 | D.2∶3 |
目前人们掌握了可充电锌—空气电池技术,使这种电池有了更广泛的用途。这种电池使用特殊技术吸附空气中的氧,以苛性钠为电解质,电池放电时的总反应为2Zn+O2 2ZnO,下列判断正确的是( )
2ZnO,下列判断正确的是( )
| A.放电时,OH-向负极方向移动 |
B.放电时,正极反应式为Zn+2OH--2e- ZnO+H2O ZnO+H2O |
| C.充电时,Zn发生氧化反应 |
D.充电时,阴极反应为O2+2H2O+4e- 4OH- 4OH- |
将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上并压紧(如图所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数如下表(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大: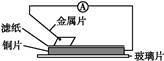
| 金属 |
电子流动方向 |
电压/V |
| 甲 |
甲→Cu |
+0.78 |
| 乙 |
Cu→乙 |
-0.25 |
| 丙 |
丙→Cu |
+1.35 |
| 丁 |
丁→Cu |
+0.30 |
依据记录数据判断,下列结论中正确的是( )
A.将甲、乙形成的合金露置在空气中,甲先被腐蚀
B.金属乙能从硫酸铜溶液中置换出铜
C.在四种金属中丙的还原性最弱
D.甲、丁若形成原电池时,甲为正极
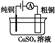
有关下列四个常用电化学装置的叙述中,正确的是( )
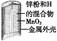 |
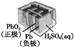 |
 |
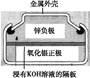 |
| 图Ⅰ 碱性 锌锰电池 |
图Ⅱ 铅 硫 硫酸蓄电池 |
图Ⅲ 电解精炼铜 |
图Ⅳ 银锌 纽扣电池 |
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液中浓度始终不变
D.图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag