欲配制1.00mol.L-1的NaCl溶液1000mL,需要使用的仪器和药品是
| A.500mL容量瓶,58.5gNaCl | B.500mL容量瓶,117gNaCl |
| C.1000mL容量瓶,58.5gNaCl | D.1000mL容量瓶,117 gNaCl |
已知:25℃ H2C2O4K1 = 5.4×10-2,K2 = 5.4×10-5;H2CO3 K1=4.5×10-7,K2= 4.7×10-11;下列离子方程式一定不正确的是
| A.H2C2O4 +CO32-= HCO3-+HC2O4- | B.HC2O4-+CO32-= HCO3-+C2O42- |
| C.H2C2O4 +HCO3-=HC2O4-+H2O+CO2 | D.H2C2O4+CO32-= C2O42-+H2O+CO2 |
下图是向MgCl2、AlCl3混合溶液中,先后加入试剂A、B时所得沉淀物质的量y(mol) 与试剂体积V(mL)间的关系图。开始滴加6mL试剂A后继续滴加A若干,之后改滴试剂B。以下结论正确的是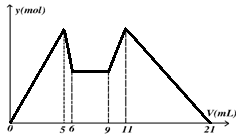
A.A可能是NaOH,B可能是盐酸,且2 c(A)=c(B)
B.原混合液中,c(Al3+)∶c(Mg2+)∶c(Cl-)=1∶2∶7
C.A可能是Ba(OH)2,B可能是硫酸,且c(A)=2c(B)
D.若A和B均为一元强酸或一元强碱,则滴加7mL试剂A后改滴试剂B
中学常见物质A、B、C、D、E、X,存在下图转化关系(部分生成物和反应条件略去)。下列推断不正确的是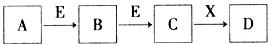
A.若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
B.若D是一种强碱,则A、B、C均可与X反应生成D
C.若D为NaCl,且A可与C反应生成B,则E可能是CO2
D.若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B
将Cl2与SO2混合均匀后,分别通入到少量下列溶液中,溶液颜色一定会褪去的是
| A.I2与淀粉混合溶液 | B.KMnO4溶液 | C.品红溶液 | D.紫色石蕊试剂 |
海洋中资源丰富,如下图所示,下列有关说法正确的是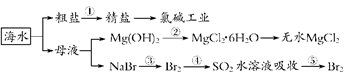
| A.工段③④⑤是溴元素的富集过程,③④⑤中均发生了氧化还原反应 |
| B.工段②中结晶出的MgCl2·6H2O可在空气中受热分解制无水MgCl2 |
| C.氯碱工业通过电解NaCl溶液,主要生产Cl2、H2和纯碱 |
| D.工段①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,操作顺序为:加入足量BaCl2溶液→加入足量NaOH溶液→加入足量Na2CO3溶液→加入足量盐酸→过滤 |