某温度下,已知反应mX(g)+ nY(g) 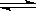 qZ(g)△H>0,m + n>q,在体积一定的密闭容器中达到平衡,下列叙述正确的是()
qZ(g)△H>0,m + n>q,在体积一定的密闭容器中达到平衡,下列叙述正确的是()
| A.反应速率υ正(X) =(n/m)υ逆(Y) | B.加入X,反应的△H增大 |
| C.增加Y的物质的量,X的转化率增大 | D.降低温度,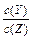 的值变小 的值变小 |
在恒温恒压的密闭容器中,充入 4L X和3L Y的混合气体,在一定条件下发生下列反应:
4X(g)+3Y(g)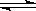 2Q(g)+ nR(g)达到平衡时测得 X的转化率为 25%,此时混合气体的体积为6.5L。则该反应方程式中的n值是()
2Q(g)+ nR(g)达到平衡时测得 X的转化率为 25%,此时混合气体的体积为6.5L。则该反应方程式中的n值是()
| A.8 | B.6 | C.5 | D.3 |
 硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是( )
硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是( )
| 实验 |
反应温度/℃ |
Na2S2O3溶液 |
稀H2SO4 |
H2O |
||
| V/mL |
c/(mol·L-1) |
V/mL |
c/(mol·L-1) |
V/mL |
||
| A |
25 |
5 |
0.1 |
10 |
0.1 |
5 |
| B |
25 |
5 |
0.2 |
5 |
0.2 |
10 |
| C |
35 |
5 |
0.1 |
10 |
0.1 |
5 |
| D |
35 |
5 |
0.2 |
5 |
0.2 |
10 |
用石墨作电极,电解1 mol/L下列物质的溶液,溶液的pH保持不变的是()
| A.HCl | B.NaOH | C.Na2SO4 | D.NaCl |
根据以下3个热化学方程式
2H2S(g)+3O2(g)=2SO2(g)+2H2O(1)△H=—Q1kJ·mol-1
2H2S(g)+O2(g)=2S(s)+2H2O(1)△H=—Q2kJ·mol-1
2H2S(g)+O2(g)=2S(s)+2H2O(g)△H=—Q3kJ·mol-1
对Q1、Q2、Q3三者大小关系的判断正确的是()
| A.Q1>Q2>Q3 | B.Q1>Q3>Q2 | C.Q3>Q2>Q1 | D.Q2>Q1>Q3 |