某实验小组用下列装置进行乙醇催化氧化的实验。已知:乙醛可被氧化为乙酸。
⑴实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式______________________、______________________。
⑵在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应
是 反应。
⑶若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有 。要除去该物质,可在混合液中加入 (填写字母)。
| A.氯化钠溶液 | B.苯 | C.碳酸氢钠溶液 | D.四氯化碳 |
然后,再通过 (填实验操作名称)即可除去。
某同学用0.10 mol/L的HCl溶液测定未知浓度的NaOH溶液,其实验操作如下:
| A.用碱式滴定管量取20.00mLNaOH溶液注入锥形瓶,同时滴加2-3滴酚酞试液; |
| B.用待测NaOH溶液润洗碱式滴定管; |
| C.把滴定管用蒸馏水洗净; |
| D.用标准HCl溶液润洗酸式滴定管后,将标准HCl溶液注入酸式滴定管至距离刻度“0”以上2—3cm处,再把酸式滴定管固定好,调节液面; |
E.检查滴定管是否漏水;
F.另取锥形瓶,再重复以上操作1—2 次;
G.把锥形瓶放在酸式滴定管下边,瓶下垫一张白纸,边滴边摇动锥形瓶,直到加入l滴酸液后溶液颜色突变并在半分钟内不再变色为止,记下滴定管液面所在的刻度。请回答下列问题:
(1)滴定操作的正确顺序是:(填字母)→C→→B→→→ __。
(2)G步操作中应在锥形瓶下边垫一张白纸的作用是。
(3)D步操作中液面应调节到。
(4)当观察到锥形瓶中,时,即可读数。若滴定前平视读数,滴定终点仰视读数,则由此计算得到的NaOH溶液浓度。(填“偏大”、“偏小”、“无影响”)
某实验小组用下列装置进行乙醇催化氧化的实验。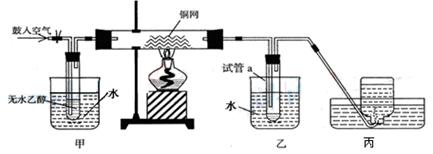
(1)请写出乙醇催化氧化的化学方程式。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是反应(填“吸热”或“放热”)。
(2)甲和乙两个水浴作用不相同。
甲中盛(填“热水”或“冷水”)作用是;乙中盛(填“热水”或“冷水”)作用是。
(3)丙中集气瓶内收集到的气体的主要成分是。
(4)如何要检验试管a中收集到的反应生成物。
(1)在实验室里制取乙烯常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,有人设计如下图所示实验以确认上述混和气体中有C2H4和SO2。(乙烯的制取装置略)
①Ⅰ、Ⅱ、Ⅲ、Ⅳ装置可盛入的试剂是Ⅰ__________、Ⅱ__________、Ⅲ__________、Ⅳ__________。(将下列有关试剂的序号填入空格内)
A.品红溶液 B.NaOH溶液 C.浓H2SO4 D.KMnO4酸性溶液
② 乙醇制取乙烯的反应装置此处略去,写出该反应的化学方程式:
③ 能说明SO2气体存在的现象是_____________________________________________。
④ 使用装置Ⅲ的目的是_____________________________________________________。
⑤ 确定含有乙烯的现象是___________________________________________________。
(2)1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下是无色液体,密度2.18g/cm3,沸点131.4℃,熔点9.79℃,不溶于水、易溶于醇、醚、丙酮等有机溶剂。在实验中可以用乙烯来制备1,2-二溴乙烷。 请填写下列空白:
①写出用乙烯制备1,2-二溴乙烷的化学方程式:。
②要检验某溴乙烷中的溴元素,正确的实验方法是
A.加入氯水振荡,观察水层是否有棕红色出现
B.滴入AgNO3溶液,再加入稀HNO3,观察有无浅黄色沉淀生成
C.加入NaOH溶液共热,冷却后加入AgNO3溶液,观察有无浅黄色沉淀生成
D.加入NaOH溶液共热,然后加入稀HNO3使溶液呈酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成
工业生产的纯碱中常含有少量NaCl杂质。为测定某纯碱样品的纯度,化学课外活动小组设计了两种实验方案:
【方案一】取样品溶解后,加试剂使CO32-沉淀,测定沉淀的质量。
【方案二】用稀酸将CO32-转化为CO2,测定CO2的质量。
(1)方案一的操作步骤有:①称量样品W1 g并溶解样品;②加入足量的BaCl2溶液;③过滤;④洗涤;⑤干燥;⑥称量沉淀W2 g并进行恒重操作,最后称量沉淀W3 g。
称量时所需定量实验仪器为__________。判断是否达到恒重的标准是___________。根据方案一的数据,算出样品中纯碱的质量分数为__________________(用代数式表示)。
(2)方案二的实验装置如下图: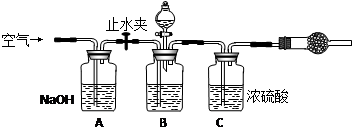
操作步骤有:①检查装置的气密性;②在干燥管内装满碱石灰,称量质量为W1 g;③称量W2 g样品装入广口瓶B中;④缓缓鼓入空气数分钟;⑤关闭止水夹,缓慢加入稀H2SO4至不再产生气体为止;⑥打开止水夹;⑦缓缓鼓入空气数分钟,再称量干燥管,质量为W3 g。
根据方案二的数据,算出样品中纯碱的质量分数为__________________(用代数式表示)。
上图中装置A的作用是_____________________。装置C的作用是___________________。如果没有装置A和实验操作④⑦,会导致测量结果______________(填“偏大”、“偏小”或“无影响”)。有同学认为空气中的水蒸气会进入干燥管导致测量结果__________(填“偏大”、“偏小”或“无影响”),改进措施可以是________________________。
喷泉是一种常见的自然现象,其产生的原因是存在压强差。制取氨气并完成喷泉实验(图中夹持装置均已略去)。 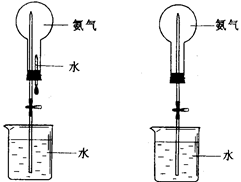

(1)写出实验室制取氨气的化学方程式:。
(2)收集氨气应使用法。
(3)要得到干燥的氨气可选用下列 做干燥剂。
| A.浓硫酸 | B.碱石灰 | C.NaOH固体 | D.P2O5固体 |
(4)用图1装置进行喷泉实验,烧瓶已装满干燥氨气,引发水上
喷的操作是。该实验的原理是。
(5)如果只提供如图2的装置,请举例说明引发喷泉法。