已知某溶液中只存在OH-、H+、Cl-、NH4+四种离子,其离子浓度可能有如下关系:
① c(Cl—)>c(NH4+)>c(H+)>c(OH—) ② c(Cl—)>c(NH4+)>c(OH—)>c(H+)
③ c(NH4+)>c(Cl—)>c(OH—)>c(H+) ④ c(NH4+) =c(Cl—)>c(OH—)=c(H+)
下列说法正确的是: ( )
| A.若①正确,则溶液中溶质一定为NH4Cl |
| B.若③正确,则溶液中c(NH3·H2O) + c(NH4+)>c(Cl—) |
| C.若④正确,且盐酸和氨水体积相等,则盐酸中c(H+)等于氨水中c(OH—) |
| D.溶质不同时,上述四种关系式均可能成立 |
我国支持“人文奥运”的一个重要体现是坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是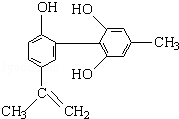
①该物质属于芳香族化合物
②该有机物的分子式为C15H18O3
③该物质所有的碳原子一定在同一个平面上
④遇FeCl3溶液呈紫色,因为该物质与苯酚属于同系物
⑤1mol该化合物最多可与3mol NaOH发生反应
⑥1mol该化合物最多可与含3molBr2的溴水发生取代反应
| A. |
①⑤⑥ |
B. |
①④⑤ |
C. |
①④⑥ |
D. |
②③④ |
某链状有机物分子中含有m个﹣CH3,n个﹣CH2﹣,a个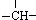 ,其余为﹣NH2,则﹣NH2的数目可能是
,其余为﹣NH2,则﹣NH2的数目可能是
| A. |
2n+3﹣m |
B. |
a+2﹣m |
C. |
n+m+a |
D. |
a+2n+2﹣m |
下列不是高聚物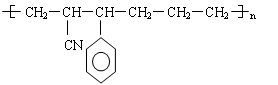 的单体的是
的单体的是
| A.CH2=CH-CN | B.CH2=CH-CH3 |
C.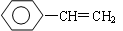 |
D.CH2=CH2 |
下列化学方程式或离子方程式正确的是
| A. |
乙酸与碳酸钠溶液反应:2H++CO32﹣=CO2↑+H2O |
|
| B. |
甲醛与足量新制Cu(OH)2浊液反应:HCHO+2Cu(OH)2 HCOOH+Cu2O↓+2H2O HCOOH+Cu2O↓+2H2O |
|
| C. |
实验室用液溴和苯在催化剂作用下制溴苯: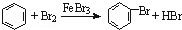 |
|
| D. |
将CO2通入苯酚钠溶液: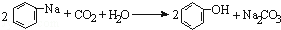 |
下列各组物质不属于同分异构体的是
| A.苯和环己烷 |
| B.邻氯甲苯和对氯甲苯 |
| C.丙醛(CH3CH2CHO)和丙烯醇(CH2=CHCH2OH) |
| D.苯甲醇和对甲基苯酚 |