下列实验操作中,正确的是:
| A.在容量瓶中直接溶解氢氧化钠固体 |
| B.向试管中滴加试剂时,将滴管下端紧靠试管内壁 |
| C.使用试纸检验溶液的性质时,将试纸浸入溶液中 |
| D.用托盘天平称量药品时,左盘放药品,右盘放砝码 |
M是一种冶疗艾滋病的新药(结构简式见下图),已知M分子中-NH-COO-基团(除H外)与苯环在同一平面内,关于M的以下说法正确的是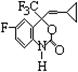
| A.该物质易溶于水 |
| B.M能发生加聚反应 |
| C.M的分子式为C13H12O2NF4 |
| D.M分子内至少有13个碳原子在同一平面内 |
对下图装置的叙述错误的是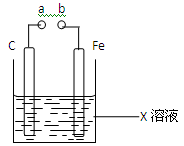
| A.X如果是Fe2(SO4)3,则不论a和b是否用导线连接成通路,铁片均发生氧化反应。 |
| B.X如果是CuSO4,a和b分别连接直流电源正、 负极,一段时间后铁片质量增加。 |
| C.X如果是HCl,则不论a和b用导线连接还是 a和b分别连接直流电源的正、负极时,H+的移动方向均相同。 |
| D.X如果是NaCl,则a和b连接时,该装置可模拟生铁在食盐水中被腐蚀的过程。 |
已知如下两个热化学反应方程式。
下列说法不正确的是
| A.反应①、②都属于加成反应 |
| B.在通常条件下,反应①、②都能自发进行 |
| C.反应①吸热、反应②放热的事实说明苯环中含有的并不是碳碳双键 |
| D.反应①、②中的所有有机物均可使溴水层褪色,但褪色原理不完全相同 |
用惰性电极电解一段时间后(溶质都有剩余),甲、乙两池串联且甲乙两池中溶液的pH变化趋势相同,且两阳极、两阴极的反应产物的物质的量分别相等的是
| A |
B |
C |
D |
|
| 甲 池 |
HCl(aq) |
CuCl2(aq) |
NaOH(aq) |
H2SO4(aq) |
| 乙 池 |
NaCl(aq) |
K2SO4(aq) |
CuSO4(aq) |
AgNO3(aq) |
坚决反对运动员服用兴奋剂,是“人文奥运”的一个基本原则。某一种兴奋剂的结构简式为
有关该有机物的说法不正确的是
| A.它可使酸性高锰酸钾溶液褪色,也能使溴水褪色 |
| B.它属于芳香烃 |
C.它与 不是同分异构体 不是同分异构体 |
| D.它既可发生加成反应,又可发生取代反应 |