如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解。假设在电解过程中产生的气体全部逸出,下列说法正确的是 
| A.甲、乙两烧杯中溶液的pH均保持不变 |
| B.甲烧杯中a的电极反应式为:4OH—―4e—=O2↑+2H2O |
| C.当电解一段时间后,将甲、乙两溶液混合,一定会产生蓝色沉淀 |
| D.当b极增重3.2g时,d极产生的气体为2.24L(标准状况) |
肼(N2H4)—空气燃料电池是一种环保碱性燃料电池,其电解质溶液是20%—30%的KOH溶液。电池总反应为:N2H4+O2=N2↑+2H2O。下列关于该燃料电池工作时的说法正确的是()
| A.溶液中阴离子物质的量基本不变 |
| B.正极的电极反应式是:O2+4H++4e-=2H2O |
| C.正极的电极反应式是:N2H4+4OH――4e-=H2O+N2↑ |
| D.溶液中阴离子向正极移动 |
根据下列实验现象,所得结论正确的是()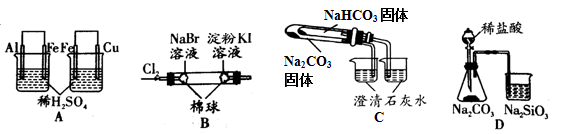
| 实验 |
实验现象 |
结论 |
| A |
左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 |
氧化性:Al3+>Fe2+>Cu2+ |
| B |
左边棉花变为橙色,右边棉花变为蓝色 |
氧化性:Cl2>Br2>I2 |
| C |
右烧杯中澄清石灰水变浑浊,左边烧杯中无明显变化 |
热稳定性:Na2CO3>NaHCO3 |
| D |
锥形瓶中有气体产生,烧杯中液体变浑浊 |
非金属性:Cl>C>Si |
下列关于有机物的说法中,错误的是( )
| A.CCl4可由CH4制得,可萃取碘水中的碘 |
| B.石油和天然气的主要成分都是碳氢化合物 |
| C.乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 |
| D.苯不能使酸性KMnO4溶液褪色,因此苯不能发生氧化反应 |
下列说法正确的是()
| A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可加快产生氢气的速率 |
| B.对于反应2H2O2=2H2O+O2↑, 加入MnO2或升高温度都能加快O2的生成速率 |
| C.将铜片放入稀硫酸中,无现象。若再向所得溶液中加入硝酸银溶液,一段时间后,由于形成原电池,可看到有氢气产生 |
| D.100mL 2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速度不变 |
下列叙述中错误的是( )
A.在平衡体系PCl5(g) PCl3(g)+Cl2(g)中加入一定量的37Cl2,一段时间后37Cl存在于五氯化磷、三氯化磷和氯气这三种物质中 PCl3(g)+Cl2(g)中加入一定量的37Cl2,一段时间后37Cl存在于五氯化磷、三氯化磷和氯气这三种物质中 |
| B.CH3COOH与H18O-CH2CH3发生酯化反应是可逆反应,达到平衡后,18O一定仅存在于乙醇和乙酸乙酯分子里,不可能存在于乙酸和水分子里 |
| C.在氧气中完全燃烧后生成物只有CO2和H2O的有机物一定是烃 |
| D.CH2Cl2没有同分异构体的事实证明了甲烷分子是以碳原子为中心的正四面体结构 |