小娟想测定Cu-Zn合金和Cu-Ag合金中铜的质量分数,实验室只提供了一瓶末标明溶质质量分数的稀盐酸和必要的仪器。
(1)你认为她能测出铜的质量分数的合金是__________________合金。
(2)小娟取该合金的粉末32.5 g,与足量该盐酸充分反应后,经测定产生了0.4 g气体,请你帮助她计算出该合金中铜的质量分数。
如图所示,将0.1mol氧化铜与一定量的碳混合加热,充分反应(试管中的空气已被除去)。
(1)计算该实验最多可以生成多少克二氧化碳?(请根据化学方程式列式计算)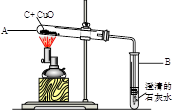
(2)实验前后分别称量了装置A和装置B的质量如表中所示。若数据Ⅰ准确,请回答:
a反应后A中固体的成分是_。
b数据Ⅱ存在的问题是_,可能的原因是。
| 反应前质量(g) |
反应后质量(g) |
||
| Ⅰ |
装置A |
125.3 |
124.2 |
| Ⅱ |
装置B |
152 |
152.3 |
如图是某品牌补铁剂标签的部分内容。请回答:
(1)C4H2FeO4由种元素组成,其中C、H元素的原子个数比为;
(2)缺铁性贫血中的“铁”是指(填“铁元素”、“铁原子”或“单质铁”);
(3)C4H2FeO4的摩尔质量是g/mol。
某锌样品15g加入50g稀硫酸中(杂质既不溶于水,也不与稀硫酸反应),充分反应后,称得烧杯内物质的总质量为64.6g。试计算:
(1)生成氢气的体积。(精确到0.1L,在标准状况下氢气的密度为0.9g/L)
(2)锌粒中所含锌的质量分数(精确到0.1%)。
实验室需用氯酸钾制取氧气,化学方程式: 2 KClO3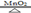 KCl + 3O2↑。现将 29.4g 氯酸钾与 5.6g 二氧化锰的混合物加热一段时间后,冷却,称量剩余固体的质量为 25.4g。回答:
KCl + 3O2↑。现将 29.4g 氯酸钾与 5.6g 二氧化锰的混合物加热一段时间后,冷却,称量剩余固体的质量为 25.4g。回答:
(1)生成氧气的质量是多少?
(2)剩余固体中氯化钾质量是多少?
(3)固体剩余物中是否还含有氯酸钾?
实验室高温煅烧125g含CaCO380%的石灰石(杂质不分解也不与酸反应),一段时间后,停止实验,冷却后用剩余的固体处理废盐酸。问能否处理含70gHCl的废盐酸,请写出计算过程。
已知:CaCO3 CaO+ CO2↑
CaO+ CO2↑
CaO+2HCl=CaCl2+H2O
Ca(OH)2+2HCl=CaCl2+2H2O