下列分子和离子的中心原子价层电子对几何构型为四面体且分子或离子空间的构型为V形的是( )
| A.NH4+ | B.PH3 | C.H3O+ | D.OF2 |
由徐光宪院士发起、院士学子同创的《分子共和国》科普读物最近出版了。全书形象生动地戏说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、 H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星。
(1)写出Fe3+的电子排布式。
(2)与CO2互为等电子体的一种离子为(填化学式)。
(3)NH3分子中氮原子的杂化轨道类型是。
(4)1 mol CH3COOH中含有的σ键的数目为。
(5)TiO2的天然晶体中,最稳定的一种晶体结构如图,黑球表示原子。
(6)二茂铁(C5H5)2Fe是Fe2+与环戊二烯基离子结合形成的小分子化合物(如上图),该化合物中Fe2+与环戊二烯基离子之间以相结合(填字母)。
a.离子键
b.金属键
c.配位键
d.氢键
e.范德华力
900℃时,向2.0L恒容密闭容器中充入0.40mol乙苯,发生反应: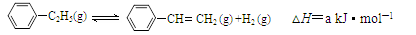 。经一段时间后达到平衡。反应过程中测定的部分数据见下表:
。经一段时间后达到平衡。反应过程中测定的部分数据见下表:
| 时间/min |
0 |
10 |
20 |
30 |
40 |
| n(乙苯)/mol |
0.40 |
0.30 |
0.24 |
n2 |
n3 |
| n(苯乙烯)/mol |
0.00 |
0.10 |
n1 |
0.20 |
0.20 |
下列说法正确的是
A.反应在前20 min的平均速率为v(H2)=0.004mol·L-1·min-1
B.保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08mol·L-1,则a<0
C.保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率为50.0%
D.相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2,达到平衡前v(正)>v(逆)
常温下,用0.1 mol·L-1 NaOH溶液滴定20 mL 0.1 mol·L-1CH3COOH溶液的滴定曲线如图所示。下列说法正确的是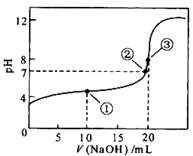
| A.点①所示溶液中:c(Na+)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
| B.点②所示溶液中:c(Na+)+c(H+)=c(CH3COO-) +c(CH3COOH) +c(OH-) |
| C.点③所示溶液中:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
D.在整个滴定过程中:溶液中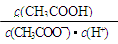 始终不变 始终不变 |
下列根据实验操作和现象所得出的结论正确的是
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
向浓度均为0.1 mol·L-1的NaCl和NaI混合溶液中滴加少量AgNO3溶液 |
先出现黄色沉淀 |
Ksp(AgCl)<sp(AgI) |
| B |
向苯酚浊液中加入Na2CO3溶液 |
溶液变澄清 |
酸性:苯酚>HCO3— |
| C |
向蓝色石蕊试纸上滴加新制氯水 |
试纸边缘呈红色色,中间为白色 |
氯水既有酸性又有还原性 |
| D |
淀粉与稀硫酸混和一段时间后,滴加银氨溶液并水浴 |
无银镜出现 |
淀粉没有水解 |
化合物Ⅲ是合成中药黄芩中的主要活性成分的中间体,合成方法如下:
下列有关叙述正确的是
| A.I在空气中能稳定存在 |
| B.II中所有原子均有可能共面 |
| C.可用FeCl3溶液鉴别有机物II和III |
| D.1mol产物III与足量溴水反应,消耗Br2的物质的量为1.5mol |