元素周期表中某区域的一些元素多用于制造半导体材料,它们是( )
| A.左下方区域的金属元素 | B.右上方区域的非金属元素 |
| C.金属元素和非金属元素分界线附近的元素 | D.稀有气体元素 |
胆固醇是人体必需的生物活性物质,分子式为C27H46O。一种胆固醇酯是液晶材料,分子式为 C34H50O2 。生成这种胆固醇酯的酸是 ( )
| A.C6H13COOH |
| B.C6H5COOH |
| C.C7H15COOH |
| D.C6H5CH2COOH |
尿素是第一个人工合成的有机物,下列关于尿素的叙述不正确的是( )
| A.尿素是一种氮肥 |
| B.尿素是人体新陈代谢的一种产物 |
| C.尿素能发生水解反应 |
| D.尿素是一种酸性物质 |
A、B两种有机物组成的混合物,当混合物质量一定时,无论A、B以何种比例混合,完全燃烧产生二氧化碳的量均相等,符合上述条件的组合是( )
①同分异构体 ②同系物 ③具有相同的实验式 ④碳的质量分数相同
A. ①②③ B. ①③④
C. ②③④ D. ①②④
在2HCHO + NaOH (浓) CH3OH +
CH3OH + 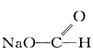 的反应中,甲醛( )
的反应中,甲醛( )
| A.仅被氧化 | B.仅被还原 |
| C.既被氧化,又被还原 | D.既未被氧化,又未被还原 |
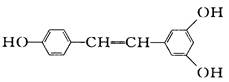 广泛存在于食物(例如桑葚、花生,尤其是葡萄)中,它可能具有抗癌性。能够跟1 mol该化合物起反应的Br2和H2的最大用量分别是( )
广泛存在于食物(例如桑葚、花生,尤其是葡萄)中,它可能具有抗癌性。能够跟1 mol该化合物起反应的Br2和H2的最大用量分别是( )
| A.1 mol、1 mol | B.3. 5 mol、7 mol |
| C.3. 5 mol、6 mol | D.6 mol、7 mol |