已知化合物A与B、丙与丁的元素组成相同,且四种物质中都含有同一种元素。A与B在常温下均呈液态。D与F都为固体单质,且D、 F与甲的浓溶液在常温作用都无明显现象,加热时有大量气体产生。(相关转化部分反应条件和生成物未标出)。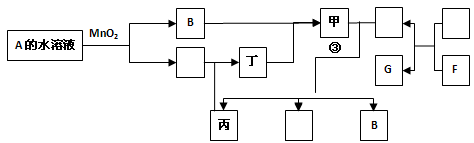
(I)写出A的电子式 。
(II)若反应①除生成甲外还生成丙,写出反应①的化学方程式: 。
(III)若A与丙可以化合生成甲;D与甲的浓溶液加热条件下可以生成三种化合物乙、丙、B,乙、丙、B常温下又可以发生反应④生成甲和另一化合物X。回答下列各小题:
2.写出反应④的离子方程式 。
3.在恒容密闭容器中,反应②达到平衡后,测得如下数据(假设不考虑副反应)。
| 实验序号 |
温度℃ |
初始C浓度 (mol·L—1) |
初始丙浓度(mol·L—1) |
C的平衡转化率 |
| 1 |
510 |
0.8 |
1.2 |
A |
| 2 |
510 |
1 |
1.2 |
50% |
| 3 |
500 |
1 |
1.2 |
B |
①此反应在510℃时平衡常数为 。
②实验l中,A的值 ;实验3中,B的值 。(选填序号)
A. 等于50% B.大于50% C.小于50% D.从本题资料,无法判断
③在实验2的平衡体系中,再增加一倍的反应物,平衡将 移动,(填“正向”、“逆向”或“不”)且C的转化率 50%(填“大于”、“小于”或“等于”)
已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,回答下列问题:
(1)该溶液中c(H+)=。
(2)HA的电离平衡常数K=;
(3)升高温度时,K(填“增大”,“减小”或“不变”)。
(4)由HA电离出的c(H+)约为水电离出的c(H+)的倍。
(1)某反应过程中的能量变化如图所示: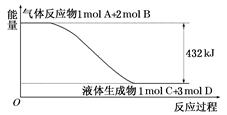
写出该反应的热化学方程式:。
(2)0.3 mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ的热量,其热化学方程式为。
如图所示,p、q为直流电源的两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡,试回答: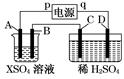
(1)p为极,A极发生了反应。
(2)C为极,可收集到;D为极,可收集到。
(3)C极的电极反应式为。
(4)在电解过程中,测C、D两极上产生气体的体积,实验数据如下表:
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
| 阴极产生气体 的体积(cm3) |
6 |
12 |
20 |
29 |
39 |
49 |
59 |
69 |
79 |
89 |
| 阳极产生气体 的体积(cm3) |
2 |
4 |
7 |
11 |
16 |
21 |
26 |
31 |
36 |
41 |
仔细分析以上实验数据,请说出变化的可能原因是
。
(5)当反应进行一段时间后,A、B电极附近溶液的pH(填“增大”“减小”或“不变”)。
(6)当电路中通过0.004 mol电子时,B极上沉积的金属X为0.128 g,则此金属的摩尔质量为。
O3可由臭氧发生器(原理如图)电解稀硫酸制得。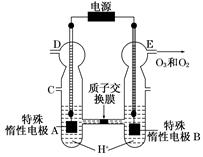
(1)图中阴极为(填“A”或“B”),其电极反应式为。
(2)若C处通入O2,则A极的电极反应式为。
(3)若C处不通入O2,D、E处分别收集到x L和y L气体(标准状况),则E处收集的气体中O3所占的体积分数为(忽略O3的分解)。
在25 ℃时,用石墨电极电解2.0 L 2.5 mol·L-1CuSO4溶液,如有0.20 mol电子发生转移,请回答下列问题:
(1)阴极发生反应,
电极反应式为;
(2)阳极发生反应,
电极反应式为;
(3)电解后得到的铜的质量是,得到氧气的体积是(标准状况),溶液的pH是;
(4)如果用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差,电解液的pH。