能用离子方程式H++OH-=H2O表示的反应是( )
| A.Cl2+2NaBr=Br2+2NaCl | B.Na2CO3+2HCl=2NaCl+H2O+CO2↑ |
| C.BaCl2+H2SO4=BaSO4↓+2HCl | D.NaOH+HNO3=NaNO3+H2O |
下列有关氯元素及其化合物的表示正确的是
A.质子数为17、中子数为20的氯原子: |
B.氯离子(Cl-)的结构示意图: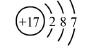 |
C.氯分子的电子式: |
| D.氯乙烯分子的结构简式:H3C-CH2Cl |
“保护环境”是我国的基本国策。下列做法不应该提倡的是
| A.采取低碳、节俭的生活方式 |
| B.按照规定对生活废弃物进行分类放置 |
| C.深入农村和社区宣传环保知识 |
| D.经常使用一次性筷子、纸杯、塑料袋等 |
a、b、c、d为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c。下列叙述错误的是
| A.d元素的非金属性最强 |
| B.它们均存在两种或两种以上的氧化物 |
| C.只有a与其他元素生成的化合物都是离子化合物 |
| D.b、c、d与氢形成的化合物中化学键均为极性共价键 |
下列曲线中,可以描述乙酸(甲,Ka=1.8×10-5)和一氯乙酸(乙,Ka=1.4×10-3)在水中的电离度与浓度关系的是
下列指定微粒的数目相等的是
| A.等物质的量的水与重水含有的中子数 |
| B.等质量的乙烯和丙烯中含有的共用电子对数 |
| C.同温、同压同体积的CO和NO含有的质子数 |
| D.等物质的量的铁和铝分别于足量氯气完全反应时转移的电子数 |