碳酸钙可用于预防和治疗钙缺乏症。某实验小组同学要测定一种钙片中碳酸钙的含量。
【查阅资料】获得的资料有:
(1)补钙剂中常加入糖类、维生素D等改善口感或增强药效。这些物质不与稀盐酸反应产生气体,高温灼烧时会燃烧或分解。
(2)碳酸钙高温灼烧分解生成氧化钙和二氧化碳。
(3)常见的碳酸钙含量测定方法:将碳酸钙粉碎,加入已知浓度的过量盐酸充分反应,然后测剩余盐酸的量,根据消耗盐酸的量最终求得碳酸钙的含量。
(4)澄清石灰水中的Ca(OH)2含量很少,100 g澄清石灰水中最多含0.15 g Ca(OH)2。
【方案设计和实施】根据资料和已学知识,该小组同学设计如下两种方案进行测定。
方案1:根据下图所示装置实验。
(1)锥形瓶中发生反应的化学方程式为 。
(2)长颈漏斗下部插入液面下的目的是 。
(3)加入药品前,检验该装置气密性的方法是 。
(4)记录数据如下:
| 钙片质量 |
空洗气瓶质量 |
澄清石灰水的质量 |
反应后洗气瓶及瓶内物质总质量 |
| 25 g |
100 g |
200 g |
300.4 g |
方案2:将钙片粉碎,加入足量的稀盐酸充分反应,根据放出气体的量计算碳酸钙的含量。记录数据如下(空烧杯质量为100 g,加入钙片质量为25 g):
| 加入稀盐酸的质量 |
100 g |
200 g |
300 g |
400 g |
| 充分反应后烧杯及杯内物质总质量 |
222.8 g |
320.6 g |
418.4 g |
518.4 g |
【分析和评价】
(1)方案1和方案2中合理的是 ,原因是 。
(2)该小组同学没有使用碳酸钙高温灼烧分解的方法(实验室可以进行该实验),原因是 。
(3)要使用【查阅资料】(3)中介绍的方法,还需要学习的是 。
【结论】经过计算,该钙片中碳酸钙的质量分数是 。
已知2Al+Fe2O3 高温2Fe+Al2O3被称为“铝热反应”。镁和氧化铜也能发生类似的反应,其化学方程式是。
某小组同学在实验室中进行镁和氧化铜反应的实验,充分反应后对于固体剩余物进行了实验探究。
【提出问题】固体剩余物是什么?
【猜想假设】假设① 铜和氧化镁;假设② ;假设③ 。
【查阅资料一】大多数金属氧化物都能与盐酸反应生成金属氯化物和水(反应中元素化合价不发生改变)。
【实验探究】请完成下列实验。
| 实验操作 |
实验现象 |
实验结论 |
| 取少量固体剩余物于试管中,向其中加入足量的稀盐酸。 |
(1)固体部分溶解,溶液为无色。 |
假设①成立。 |
| (2)。 |
假设②成立。 |
|
| (3)。 |
假设③成立。 |
【总结一】(1)对于有多种物质参加的化学反应,要推测充分反应后得到的剩余物的成分,需要考虑两个方面:一是;二是。
(2)一种金属单质可以和另一种金属氧化物反应。
【思考】是否任何一种金属单质都能与另一种金属氧化物反应?
【查阅资料二】该小组同学通过查阅资料,获得以下几组反应信息。
| 实验组别 |
I |
II |
III |
IV |
V |
| 药品 |
Al |
Fe |
Ag |
Al |
Cu |
| CuO |
CuO |
CuO |
Fe2O3 |
Fe2O3 |
|
| 相同条件下是否反应 |
是 |
是 |
否 |
是 |
否 |
【总结二】根据上表对比分析得出:金属单质与金属氧化物能发生反应,需满足的条件是。
某课外小组设计了如下图所示的实验装置,该装置既可用于制取气体,又可用于探究物质性质。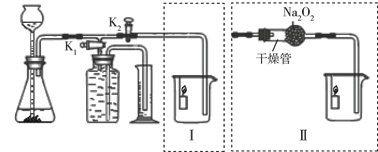
(1)当打开K1、关闭K2时,可完成用(写反应物的名称)制取氧气的实验,其中量筒的作用是。
(2)当打开K2、关闭K1时,可制得二氧化碳并验证其性质。实验室制取二氧化碳反应的化学方程式是;可验证的二氧化碳的性质是。
(3)在实验(2)中,若用II代替I,干燥管内反应的化学方程式是2Na2O2 + 2CO2 =" 2X" + Y,反应中若消耗39 g Na2O2,生成Y的质量是8 g,则X的化学式是,II中烧杯内可观察到的现象是。
化学小组同学在课外读物中看到:“通常CO2可作灭火剂,但有些物质(如Na)着火,不能用CO2熄灭。”他们决定探究CO2与Na反应的产物。
【提出猜想】CO2与Na反应可能生成4种物质:C、CO、Na2O和Na2CO3。
【查阅资料】
① Na是非常活泼的金属,常温下与O2、H2O等物质反应。
②向氯化钯(PdCl2)溶液中通入CO,产生黑色沉淀。
③Na2CO3是白色固体,易溶于水,能与CaCl2溶液发生反应,化学方程式为:Na2CO3+CaCl2= CaCO3↓+2NaCl
④Na2O是白色固体,与H2O反应生成NaOH。
⑤CaCl2、NaCl、Na2CO3、NaOH四种溶液分别与无色酚酞溶液作用比较:
| 分别向右侧溶液中 加入无色酚酞溶液 |
CaCl2 |
NaCl |
Na2CO3 |
NaOH |
| 主要实验现象 |
无色 |
无色 |
由无色变为红色 |
由无色变为红色 |
【实验过程】同学们在老师的指导下设计了如下图所示装置(部分夹持仪器已略去)。 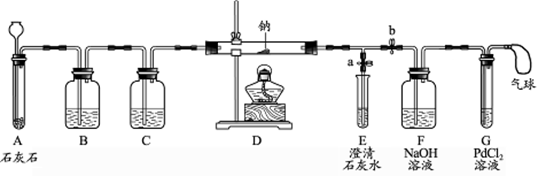
(1)实验记录
| 序号 |
实验操作 |
主要实验现象 |
实验结论及解释 |
| ① |
打开a,关闭b,由长颈漏斗注入稀盐酸 |
A中产生大量气泡 E中出现浑浊 |
E中反应的化学方程式为 |
| ② |
当E中出现浑浊时,打开b,关闭a,点燃酒精灯 |
D中Na剧烈燃烧,产生白烟 内壁附着黑色、白色固体 G中产生黑色沉淀 |
反应产物一定 有和 |
| ③ |
取D中白色固体于试管中,加水溶解,再加入CaCl2溶液 |
产生白色沉淀 |
反应产物还有 |
(2)实验反思
① 实验记录②中,E中出现浑浊再点燃酒精灯的目的是。
② 装置B、C的作用是。
③ 检验第4种物质是否存在的实验方案:取D中白色固体于试管中,。
下面是两个探究可燃物燃烧条件的实验,请回答相关问题。

图 1图 2
(1)如图1向C中加入少量白磷,再加入热水,塞好胶塞,使导管口浸入热水中,白磷不燃烧。打开K1,将A中溶液滴入B中,C中有气泡冒出,白磷燃烧。C中发生反应的化学方程式为。
此实验运用对比的方法研究了燃烧的一个条件,它是。
(2)如图2所示,在空气中放置时,两团棉花均不燃烧;若将足量二氧化碳倒入烧杯时,可以观察到的现象有:①;②粘有过氧化钠的棉花燃烧;③未粘有过氧化钠的棉花不燃烧。通过上述实验的对比分析,写出产生现象②的原因。
类比法是化学研究物质的重要方法之一。草酸(C2H204)的化学性质与碳酸相似,草酸受热会分解得到三种氧化物,某兴趣小组对草酸的有关性质进行了探究,按要求回答相关的问题:
[提出猜想](1)草酸能够使紫色石蕊试液变为色。
(2)三种氧化物可能是,该猜想的依据是。
[查阅资料]
1.无水硫酸铜是一种白色粉末物质,遇水变成蓝色的硫酸铜晶体。
2.向氯化钯溶液中通入CO,产生黑色沉淀。
[实验探究]兴趣小组为验证猜想,将草酸受热后得到的气体,依次通过了装置A、B、C: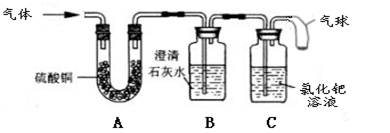
[实验结论](3)当装置A、B、C实验现象是,证明猜想是正确的。
[实验反思](4)①实验装置中气球所起的作用是。
②是否可以将装置A和B对调,其理由是。