下列离子方程式正确的是:( )
A.足量的乙酸与碳酸钠溶液反应:2H++CO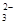 —→CO2↑+H2O —→CO2↑+H2O |
| B.醋酸溶液与新制氢氧化铜反应: 2CH3COOH+Cu(OH)2  Cu2++2CH3COO-+2H2O Cu2++2CH3COO-+2H2O |
C.苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O 2C6H5OH+CO 2C6H5OH+CO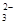 |
| D.甲醛溶液与足量的银氨溶液共热 |
HCHO+2[Ag(NH3)2]++2OH- CO
CO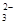 +2NH
+2NH +Ag↓+3NH3+H2O
+Ag↓+3NH3+H2O
在pH=0的溶液中,能大量共存的离子组是
| A.Na+、Mg2+、NO3-、SO42- | B.K+、Ca2+、CH3COO-、HCO3- |
| C.Fe2+、Na+、 Cl-、 NO3- | D.Ba2+、AlO2-、K+、SO42- |
以NA表示阿伏加德罗常数,下列说法正确的是
A.0.1mol Fe与足量盐酸反应,转移的电子数为0.3NA
B .28gCO中所含的原子数为2NA
.28gCO中所含的原子数为2NA
C.0.1mol/LNa2CO3溶液中,含有CO32— 数为0.1NA
D.标况下,22.4L苯的分子数为NA
化学与生活、社会密切相关。下列说法不正确的是
| A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 |
| B.凡含有食品添加剂的食物对人体健康均有害,不可食用 |
| C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 |
| D.提倡人们购物时不用塑料袋,是为了防止白色污染 |
铋(Bi)在医药方面有重要应用。下列关于 和
和 的
的 说法正确的是
说法正确的是
A. 和 和 是同一种核素 是同一种核素 |
B. 和 和 的中子数相同 的中子数相同 |
C. 和 和 互称为同位素 互称为同位素 |
D. 和 和 的质量数相同 的质量数相同 |
一定温度下,在容积不变的密闭容器中发生反应:2NO2(g) 2NO(g)+ O2(g),能说明该反应已达化学平衡状态的是
2NO(g)+ O2(g),能说明该反应已达化学平衡状态的是
①生成n mol O2的同时生成2n mol NO2
②生成n mol O2的同时生成2n mol NO
③容器内气体的压强不再改变④混合气体的颜色不再改变
⑤混合气体的密度不再改变
| A.①②④ | B.②③⑤ | C.①③④ | D.①②③④⑤ |