在一密闭容器中进行反应:2SO2(g)+O2(g)  2SO3(g)测得开始时,SO2、O2、和SO3的浓度分别为0.2mol∙L-1、0.1mol∙L-1、0.2mol∙L-1,在反应过程中不断测该容器中各物质的浓度,下列测定数据肯定不正确的是
2SO3(g)测得开始时,SO2、O2、和SO3的浓度分别为0.2mol∙L-1、0.1mol∙L-1、0.2mol∙L-1,在反应过程中不断测该容器中各物质的浓度,下列测定数据肯定不正确的是
| A.O2为0.15mol∙L-1 | B.SO2为0.25mol∙L-1 |
| C.SO3为0.4mol∙L-1 | D.O2、SO3的浓度相等 |
亚氯酸钠(NaClO2)是一种性能优良的漂白剂,但在酸性溶液发生分解:
5HClO2→4ClO2+H++Cl-+2H2O.
向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为pH相同的稀硫酸,开始时反应缓慢,稍后产生气体速度较快,速度变化的原因是
| A.逸出ClO2使生成物浓度降低 | B.酸使HClO2的分解加速 |
| C.溶液中的H+起催化作用 | D.溶液中的Cl-起催化作用 |
如图的装置,左为铁电极,右为石墨电极,a为水或某种溶液。若两电极直接连接或外接电源,石墨上可能发生的反应是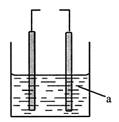
①2H++2e→H2↑ ②O2+4e+2H2O→4OH-③2Cl--2e→Cl2↑
| A.① | B.② | C.①② | D.①②③ |
以下实验所用的试剂不合理的是
| 选项 |
实验目的 |
所用试剂 |
| A |
比较Fe3+和Cu2+的氧化性 |
FeCl3溶液和Cu |
| B |
比较镁和铝的金属性 |
MgCl2溶液、AlCl3溶液、NaOH溶液 |
| C |
比较硫和氯的非金属性 |
氢硫酸、氯气 |
| D |
比较苯酚和碳酸的酸性 |
0.1mol/L苯酚钠、0.1mol/L碳酸钠溶液pH试纸 |
用定量的方法,可用于鉴别邻甲基苯酚和间甲基苯酚的试剂是
| A.酸性高锰酸钾溶液 | B.浓溴水 | C.氯化铁溶液 | D.氢氧化钠溶液 |
非金属元素R位于第三周期,其原子的最外层有n个电子,则以下叙述错误的是
| A.R原子的电子数为10+n | B.R能形成Rn-离子 |
| C.R的最高氧化物为R2On或ROn/2 | D.R的气态氢化物的化学式是H8-nR |