根据下表给出的几种物质的溶沸点数据,判断下列说法中错误的是( )
| |
NaCl |
MgCl2 |
AlCl3 |
SiCl4 |
单质B |
| 熔点/℃ |
810 |
710 |
180 |
—68 |
2300 |
| 沸点/℃ |
1465 |
1418 |
160 |
57 |
2500 |
A、SiCl4是分子晶体; B、单质B可能是原子晶体;
C、AlCl3加热能升华; D、NaCl 比MgCl2更易熔化。
下列说法不正确的是__________。
| A.物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的; |
B.对于Al(OH)3(s)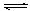 Al(OH)3(aq) Al(OH)3(aq) 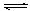 Al3++3OH-,前者为溶解平衡,后者为电离平衡; Al3++3OH-,前者为溶解平衡,后者为电离平衡; |
| C.除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3大 |
| D.沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全。 |
在同温同压下,1体积某气态烃与2体积氯化氢完全加成的产物能与4体积氯气发生取代反应,所得产物中不再含有氢元素,则原气态烃是
| A.丙炔 | B.乙炔 | C.丙烯 | D.丁烯 |
用乙炔原料制取CH2Br—CHBrCl,可行的反应途径是
| A.先加Cl2,再加Br2 | B.先加Cl2,再加HBr |
C.先加HCl,再加 HBr HBr |
D.先加HCl,再加Br2 |
把Mmol H2和N mol C2H4混合,在一定条件下使它们一部分发生反应生成W mol C2H6将反应后的混合气体完全燃烧,消耗氧气的物质的量为()mol
| A.M+3N | B.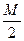 +3N +3N |
C.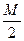 +3N+ +3N+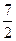 W W |
D.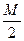 +3N— +3N—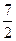 W W |
下列各物质的名称正确的是]
| A.3,3-二甲基丁烷 | B.2,3,3-三甲基丁烷 |
| C.2,2-二甲基-3-乙基丁烷 | D.2,3-二甲基-4-乙基己烷 |