将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴下氧气含量比边缘少。下列说法正确的是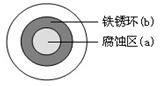
| A.液滴中的Cl―由a区向b区迁移 |
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e- 4OH- 4OH- |
| C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈 |
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e- Cu2 Cu2 |
下列说法正确的是()
| A.酸碱中和反应是吸热反应 |
B.吸热反应不加热 就不会发生 就不会发生 |
| C.放热反应不用加热也一定能发生 |
| D.反应是放热还是吸热可以看反应物和生成物所具有的总能量的相对大小 |
有关化学用语正确的是()
| A.乙烯的最简式:C2H4 |
| B.乙醇的结构简式:C2H6O |
C.NaCl的电子式: |
D.乙酸 乙酯的分子式:C4H8O2 乙酯的分子式:C4H8O2 |
下列叙述正确的是()
| A.目前加碘食盐中主要添加的是KIO3 |
| B.日常生活中无水乙醇常用于杀菌消毒 |
| C.绿色食品是不含任何化学物质的食品 |
| D.在空气质量日报中CO2含量属于空气污染指数 |
下列过程所发生的化学变化属于取代反应的是
| A.在FeBr3催化作用下苯与液溴反应 |
| B.在镍做催化剂的条件下苯与氢气反应 |
| C.乙烯在空气中燃烧 |
| D.乙醇在铜做催化剂的条件下生成乙醛 |
下列关于糖类的说法正确的是
| A.所有糖类物质都有甜味,但不一定都溶于水 |
| B.葡萄糖和果糖性质不同,但分子式相同 |
| C.摄入人体的纤维素在酶的作用下能水解为葡萄糖 |
| D.葡萄糖和蔗糖不是同分异构体,但属于同系物 |