下表列出了①~⑨九种元素在周期表中的位置:
| |
ⅠA |
|
ⅧA |
|||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
|
|
|
② |
③ |
④ |
|
⑧ |
| 3 |
⑤ |
|
|
|
⑥ |
⑦ |
⑨ |
|
请按要求回答下列问题。
(1)元素④在周期表中所处位置_____ _______,从元素原子得失电子的角度看,元素④具有______ ______性(填“氧化性”、“还原性”);
(2)按气态氢化物的稳定性由弱到强的顺序排列,⑥④⑦的氢化物稳定性:____________ _______________________(写氢化物的化学式);
(3)元素⑦的原子结构示意图是___ _________;
(4)写出元素⑤形成的单质在氧气中燃烧的化学方程式______ ________________,这一反应是______ _____(填“吸热”、“放热”)反应;
(5)用电子式表示①与⑨反应得到的化合物的形成过程_________________________。
有A、B两种常见化合物组成的混合物,其焰色反应均为黄色,其相互转化关系如图(其
他物质均略去)。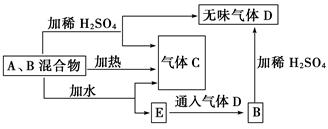
根据以上关系,回答下列问题:
(1)写出A、B、C、D的化学式:A________、B________,C________,D________。
(2)写出混合物中加水反应的化学方程式:_____________________________________
(3)加热后,若只得到一种固体化合物,则A与B的物质的量之比的最大值为________(填数字)。
雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中
共生。根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为________。
(2)上述反应中的氧化剂是________,反应产生的气体可用________吸收。
(3)As2S3和HNO3有如下反应:As2S3+10H++10NO3—=2H3AsO4+3S↓+10NO2↑+2H2O,若生成2 mol H3AsO4,则反应中转移电子的物质的量为________。若将该反应设计成一原电池,则NO2应该在________(填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2 L O2(标准状况)混合后用水吸收全部转化成浓硝酸,然后与过量的C反应,所产生的CO2的量________(选填编号)。
a.小于0.5 mol b.等于0.5 mol
c.大于0.5 mol d.无法确定
消毒剂在生产生活中有极其重要的作用,开发具有广普、高效、低毒的杀菌剂和消毒剂是今后发展的趋势。
(1)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1 mol O3转化为1 mol O2和1 mol H2O)等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是________(填序号)。
| A.Cl2 | B.H2O2 | C.ClO2 | D.O3 |
(2)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称。如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O=A+NH3↑,则生成物A的化学式为________,H2O2被称为“绿色氧化剂”的理由是____________________________________
(3)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为HClO2―→ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1 mol ClO2生成时转移的电子个数约为________。
(4)“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是__________________(用离子方程式表示)。利用氯碱工业的产物可以生产“84”消毒液,写出有关反应的化学方程式:____________。
取一定量的酸性KMnO4溶液依次进行下列实验,有关现象记录如下:
①滴加适量H2O2,紫红色褪去,并有气泡产生;
②再加入适量的PbO2固体,固体溶解,溶液又变为紫红色;
③最后通入足量的SO2气体。
请回答下列问题:
(1)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为____________________;
(2)实验③中的现象为_____________________________________________________;
(3)实验①、②中反应的离子方程式分别是__________、________。
氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)水是人体的重要组成成分,是人体中含量最多的一种物质。而“四种基本反应类型
与氧化还原反应的关系”也可用如图表达。
试写出有水参加的符合反应类型Ⅳ的一个化学方程式:________________________,其中水为________剂。
(2)氯化铵常用作焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:
CuO+____NH4Cl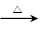 Cu+____CuCl2+N2↑+____H2O。
Cu+____CuCl2+N2↑+____H2O。
①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是________(填元素名称),氧化剂是________(填化学式)。
(3)(2011·福建高考卷节选)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500 ℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2=6CaSiO3+P4O10,10C+P4O10=P4+10CO。
每生成1 mol P4时,就有________mol电子发生转移。