下列说法正确的是( )
| A.对于有气体参加的化学反应来说,增大压强,可使活化分子百分数增多,化学反应速率一定增大 |
| B.升高温度,活化分子百分数不变,但是碰撞的频率增大,所以化学反应速率增大 |
| C.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大 |
| D.加入正催化剂,可以降低该反应的活化能,会使反应物活化分子百分数增加,所以化学反应速率加快 |
氯化铁溶液与氢氧化铁胶体具有的共同性质是
| A.两者的本质区别是氢氧化铁胶体能产生丁达尔现象。 |
| B.都能透过半透膜 |
| C.都是透明的澄清液体 |
| D.都呈红褐色 |
配置一定物质的量浓度的溶液,下列情况会使配置结果偏低的是
| A.未冷却即转移、定容 | B.未洗涤烧杯以及玻璃棒 |
| C.定容时俯视刻度线观察液面 | D.容量瓶中原有少量蒸馏水 |
实验室用下列溶质配制一种混合溶液,已知溶液中c(K+)=c(Cl-)=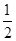 c(Na+)=c(SO42-),则其溶质可能是
c(Na+)=c(SO42-),则其溶质可能是
| A.NaCl、K2SO4 | B.KCl、Na2SO4、NaCl |
| C.KCl、Na2SO4 | D.KCl、K2SO4、Na2SO4 |
V LFe2(SO4)3溶液中含a gSO42-,取此溶液V/2 L用水稀释成2V L,则稀释后溶液的C(Fe3+)
| A.a/(576V)mol/L | B.125a/(36V)mol/L |
| C.250/(36V)mol/L | D.250a/(48V)mol/L |
100 g浓度为13.6mol/LHNO3(ρ>1g/ml )中加入A g水,浓度变为 6.8mol/L,则加入水的体积
| A.>100 ml | B.="100" ml | C.<100ml | D.不能确定 |