在101 kPa和25 ℃时,有关反应的热化学方程式如下:
C(s)+1/2O2(g) =CO(g) ΔH1=-110.5 kJ·mol-1
H2(g)+ 1/2O2(g)=H2O(g) ΔH2=-241.7 kJ·mol-1
H2(g)+ 1/2O2(g)=H2O(l) ΔH3=-285.8 kJ·mol-1
下列说法正确的是( )
| A.C(s)+H2O(g)=CO(g)+H2(g) ΔH=-131.2 kJ·mol-1 |
| B.H2燃烧热的热化学方程式为:2H2(g)+O2(g)=2H2O (l)ΔH=-571.6 kJ·mol-1 |
| C.2H2O(g)=2H2(g)+O2 (g)ΔH=-483.4 kJ·mol-1 |
| D.H2O(g)=H2O(l)ΔH=-44.1 kJ·mol-1 |
下列实验方案不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是()
| A.取a克混合物与稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克 |
| B.取a克混合物与稀盐酸充分反应,加热、蒸干、灼烧,得b克固体 |
| C.取a克混合物充分加热,减重b克 |
| D.取a克混合物与Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体 |
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) I3-(aq)+Q,某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是()
I3-(aq)+Q,某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是()
A.反应 I2(aq)+I-(aq) I3-(aq)+Q的 Q<0 I3-(aq)+Q的 Q<0 |
| B.若温度为T1、T2时,反应平衡常数分别为K1、K2,则K2>K1 |
| C.若反应进行到状态D时,一定有v正>v逆 |
| D.状态A与状态B相比,状态A的c(I2)大 |
给试管中某红色溶液加热,溶液颜色逐渐变浅,则原溶液可能是()
①滴有石蕊的NH4Cl溶液②滴有石蕊的CO2溶液③滴有石蕊的H2SO4溶液
④滴有酚酞的氨水溶液⑤滴有酚酞的氢氧化钠溶液⑥滴有酚酞的饱和氢氧化钙溶液⑦滴有酚酞的Na2CO3溶液⑧溶有SO2的品红溶液
| A.②④ | B.①③⑤⑦ | C.①④⑥⑧ | D.②④⑥ |
下列对有关反应能量变化图像的判断错误的是()
IⅡⅢⅣ
| A.I可表示需加热的放热反应 |
| B.Ⅱ可表示爆炸反应 |
| C.Ⅲ可表示无催化剂(a)和有催化剂(b)时反应的能量变化 |
| D.Ⅳ可表示醋酸和碱的中和反应 |
下列装置或操作能达到实验目的的是()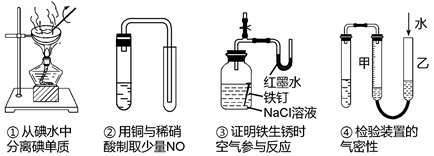
| A.①② | B.③④ | C.②③④ | D.①②③④ |