电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
① Y电极上的电极反应式为 。
在X极附近观察到的现象是 。
②电解总反应离子方程式为 。
(2)要在铁件的表面镀铜防止铁被腐蚀,则:
① Y电极的材料是 (选填纯铁、纯铜或纯锌),电极反应式是 。电解液a选用 溶液,电解过程中其浓度 (选填增大、减小或不变)。
②若电镀前X、Y两电极的质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12 g,则电镀时电路中通过的电子为 mol。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因:
。
碳正离子[例如CH5+、CH3+、(CH3)3C+等]是有机反应中重要的中间体。欧拉(G.Olah)因在此领域研究中的卓越成就而荣获1994年诺贝尔化学奖。
碳正离子CH5+可以通过CH4在“超强酸”中再获得一个H+而得到,而CH5+失去H2可得CH3+。
(1)CH3+是反应性很强的正离子,是缺电子的,其电子式是_________
(2)CH3+中4个原子是共面的,三个键角相等,键角应是_________(填角度)。
(3)(CH3)2CH+在NaOH水溶液中反应将得到电中性的有机分子,其结构简式是_________
(4)(CH3)3C+去掉H+后将生成电中性的有机分子,其结构简式是_________
在有机反应中,反应物相同而条件不同,可得到不同的主产物,下式中R代表烃基,副产物均已略去。
请写出实现下列转变的各步反应的化学方程式,特别注意写明反应条件。
(1)由CH3CH2CH2Br分两步转变为CH3CH2CHBrCH3。
(2)由(CH3)2CHCH=CH2分两步转变为(CH3)2CHCH2CH2OH。
由丁炔二醇制备1,3—丁二烯,请在下面这个流程图的空框中填入有机物的结构简式.
在实验室鉴定氯酸钾晶体和1-氯丙烷中的氯元素,现设计了下列实验操作程序:①滴加AgNO3溶液;②加NaOH溶液;③加热;④加催化剂MnO2;⑤加蒸馏水过滤后取滤液;⑥过滤后取滤渣;⑦用HNO3酸化。
(1)鉴定氯酸钾中氯元素的操作步骤是_________(填序号)。
(2)鉴定1-氯丙烷中氯元素的操作步骤是_________(填序号)。
在一定条件下,x A (g)+y B (g)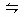 z C(g)的反应达到平衡。
z C(g)的反应达到平衡。
⑴已知A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z间的关系
是_________________________。
⑵已知C是气体,如果反应中x+y=z在增大压强时其平衡发生移动,则一定向
_______移动。
⑶已知C是气体,当其他条件不变,增大 A的物质的量时平衡不移动,则A是态。
⑷加热后C的质量分数减小,则正反应是_________(填“放热”或“吸热”)反应。