芳香族化合物A的分子式为C7H6O2,将它与NaHCO3溶液混合加热,有酸性气体产生.那么包括A在内,属于芳香族化合物的同分异构体的数目是 ( )
| A.5 | B.4 | C.3 | D.2 |
下列物质:①BeCl2②SiC③白磷④BF3⑤NH3⑥过氧化氢 , 其中含极性键的非极性分子是
| A.①③④ | B.②③⑥ | C.①④ | D.①③④⑤ |
现有四种元素的基态原子的电子排布式如下:① [Ne]3s23p4;②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是
| A.最高正化合价:③>②>① | B.原子半径:③>②>① |
| C.电负性:③>②>① | D.第一电离能:③>②>① |
下列图式表示正确的是
A.二氧化碳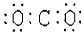 |
| B.次氯酸的结构式 H-Cl-O |
C.铝离子的结构示意图 |
D.基态碳原子的价电子排布图为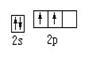 |
价电子排布式为5s25 p3的元素是
| A.第五周期第ⅢA族 | B.51号元素 |
| C.SP区的主族元素 | D.Te |
下列叙述中,正确的是
| A.1s电子云界面图是一个球面,电子云中的每个小黑点代表一个电子 |
| B.NaH中的σ键是由两个原子的s、p轨道以“头碰头”方式重叠形成的 |
| C.对于组成结构相似的分子,一定是相对分子质量越大,熔、沸点越高 |
| D.在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析 |