小林仔细阅读加碘自然盐包装袋上的说明(部分说明如图所示),提出问题与同学讨论并进行实验探究。
问题一:食盐加碘可以有效地预防
问题二:食盐是比较稳定的,而说明中强调“防热”是否因为受热会造成碘的损失?
【实验一】探究温度对碘损失率的影响
老师指导他们将一定浓度的碘酸钾溶液分成5等份,于不同温度下加热十分钟后,用硫代硫酸钠标准溶液测定碘酸钾浓度,计算碘损失率并记录如下:
| 温度 |
30℃水浴 |
50℃水浴 |
80℃水浴 |
100℃水浴 |
煮沸 |
| 碘损失率(%) |
0 |
0.3 |
0.67 |
1 |
5.56 |
分析上表可得出的结论是 。
实验后,小林建议妈妈烧菜时最好是菜出锅前再放碘盐。
问题三:烧菜时加醋对碘的损失率是否也有影响?
【实验二】探究酸碱性对碘损失率的影响
(1)此组对照实验,要控制在碘酸钾溶液的浓度和质量、加热的 和 均相同,溶液的 不同的条件下进行。
(2)实验中需要调节溶液的酸碱性,下列物质不能选用的是 (填序号)。
A.氢氧化钠 B.纯碱粉末 C.食盐晶体 D.食醋
化学兴趣小组的同学用下图所示实验装置探究气体制取,请回答下列问题
(1)图中e、f仪器的名称:e ,f 。
(2)用高锰酸钾制氧气,选用的发生装置A还需要改进地方是。
(3)用块状石灰石固体和稀盐酸溶液常温下制取二氧化碳气体时,用C装置(多孔隔板上方用来放块状固体)代替B装置的优点是。
观察图C装置,气体制取处于(填“发生”或“停止”)中,该反应方程式为。若用D装置来收集生成的二氧化碳,气体应从(填g或h)通入。
(4)实验室里用双氧水和二氧化锰反应制氧气,该实验(填“能”或“不能”)选用C装置来控制反应发生或停止。
某同学家中有一袋化肥,可能混入了其他化肥,且化肥包装袋上字迹模糊.该同学进行了如下探究,请你参与探究并填空:
【提出问题】该化肥中含有什么物质?
【收集信息】经询问得知,该化肥可能为铵态氮肥.
【提出猜想】该化肥所含的阴离子可能是Cl-、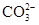 、
、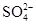 中的一种或几种.
中的一种或几种.
【实验、记录与分析】
| 实验操作步骤 |
实验现象 |
实验分析 |
| (1)取少量该化肥样品和少量熟石灰放在研钵中混合研磨 |
________ |
含有铵根离子 |
| (2)另取少量该化肥样品于试管中,加入适量的水完全溶解,滴加足量的硝酸钡溶液,再滴加少量稀硝酸,过滤 |
产生白色沉淀,沉淀不溶解 |
没有________存在 |
| (3)取(2)所得滤液少量于试管中,滴加________ |
________ |
有Cl-存在 |
【实验结论】若该化肥中只含有一种阳离子,则其中一定含有的物质是(写化学式):________________.
【实验反思】若步骤(2)中用氯化钡溶液代替硝酸钡溶液是否可行?________(选填“是”或“否”),请简要说明原因:________________________________.
某同学家中有一袋化肥,可能混入了其他化肥,且化肥包装袋上的字迹模糊.该同学进行了如下探究,请你参与探究并填空:
[提出问题]该化肥中含有什么物质?
[收集信息]经询问得知,该化肥为铵态氮肥.
[提出猜想]该化肥所含的阴离子可能是Cl-、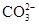 、
、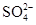 ;中的一种或几种.
;中的一种或几种.
[实验、记录与分析]
| 实验操作步骤 |
实验现象 |
实验分析 |
| (1)取少量该化肥样品和少量熟石灰放在研钵中混合研磨 |
________ |
含有铵根离子 |
| (2)另取少量该化肥样品于试管中,加入适量的水完全溶解,滴加足量的硝酸钡溶液,再滴加少量稀硝酸,过滤 |
产生白色沉淀,沉淀不溶解 |
没有________(填化学式)存在 |
| (3)取(2)中所得滤液少量于试管中,滴加________ |
________ |
有Cl-存在 |
[实验结论]若该化肥中只含有一种阳离子,则其中一定含有的物质是(写化学式)________________________________________________________________________.
[实验反思]若步骤(2)中用氯化钡溶液代替硝酸钡溶液是否可行?________(填“是”或“否”),请简要说明原因:________________________________________.
实验室有一瓶化肥的标签已脱落,只知道它是NH4Cl、(NH4)2SO4、NH4HCO3和尿素[CO(NH2)2]中的一种.请你完成以下探究:
[猜想]猜想①:该化肥是NH4Cl,
猜想②:该化肥是________,
猜想③:该化肥是NH4HCO3,
猜想④:该化肥是尿素.
[实验探究]
(1)取少量样品在研钵中与熟石灰研磨,有刺激性气味的气体放出,证明猜想________不成立;写出其中一种化肥发生该反应的化学方程式:
________________________________________________________________________.
(2)如图1,另取少量样品于试管中,滴加适量水振荡,再选图2中________滴入试管中,若无气泡放出,则猜想________不成立.
(3)在步骤(2)的试管中再滴入图2中的________,若________,则猜想①成立;若________,则猜想②成立,其反应的化学方程式为________________________________________
________________________________________________________________________.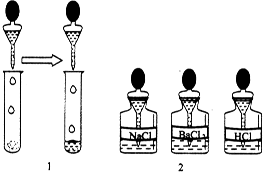
无土栽培是利用营养液栽培作物的一种方法.
(1)下列化学肥料中属于复合肥料的是________(填序号).
①硝酸铵 ②磷酸二氢铵 ③硝酸钾 ④硫酸钾
(2)某同学要在实验室配制150g溶质质量分数为2%的硝酸钾溶液,需要硝酸钾的质量为________g.
(3)现有一种无色的营养液,可能由KNO3、Ca(NO3)2、K2CO3、KCl中的一种或几种物质组成,为探究其成分,某同学设计并完成了图所示的实验.
根据以上实验,请你进行有关推断:
①由实验1可确定原营养液中一定没有的物质是________;
②根据实验1、实验2推测原营养液的组成可能有________种情况;
③若测得原营养液中K+和Cl-的数目之比为1︰1,则原营养液的组成中的溶质是________.