某化学实验小组实验结束时,将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,为回收有关金属和盐,同学们设计了如下实验方案:
试回答:
(1)步骤①中锌粉必须过量的原因是 。
(2)写出步骤①中发生的两个化学方程式 、 。
(3)要检验步骤④中加入的稀硫酸是否足量的方法是 。
(4)若实验过程中的物质损失可以忽略,最终所得硫酸锌的质量 (填“>”、“<”或“=”)原废液中硫酸锌的质量。要计算该废液中硫酸铜质量,必须要称量 的质量。
根据装置图回答。
Ⅰ.写出图中仪器a的名称是 ,仪器b的名称 。
Ⅱ.在图中若用无水醋酸钠和碱石灰两种固体药品加热制取甲烷气体,可选用的发生装置是 ;装置B 和C都可以用过氧化氢溶液和二氧化锰制取氧气,写出该反应的化学方程式 ;装置B和C相比,B装置的优点是 。
Ⅲ.以下收集装置中能用于收集氧气的是 。
Ⅳ.以下具有启普发生器功能的简易气体发生装置是 。
水和水溶液与人类的生活、生产关系密切。
①在天然水净化处理中,加活性炭的作用是 ,很多自来水厂用二氧化氯替代氯气对水进行杀菌消毒。工业上用Cl2和NaClO2来制取二氧化氯(ClO2),请配平下列化学方程式: Cl2+ NaClO2→ 2NaCl+ ClO2。
②我们用“电解水”和“氢气在氧气中燃烧”的两个探究实验来证明水的组成元素。依据下图实验回答问题: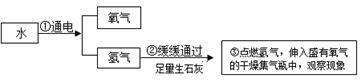
Ⅰ.上述探究水的组成的理论依据是 。
Ⅱ.写出电解水的化学方程式 ,检验正极上气体的方法是 。
Ⅲ.上图步骤③中集气瓶里观察到的现象是 。
科技节活动中,化学实验小组做了如下实验,请回答以下问题。
(1)图A所示实验可观察到“铁树”上浸有无色酚酞试液的棉团由白色变为 色,该实验中没有涉及的性质是 (填字母)。
A.氨分子是不断运动的B.氨分子有一定质量C.浓氨水具有挥发性
(2)图C所示实验发生反应的化学方程式为 。
(3)图C所示实验中,当通过导管向热水中通入氧气时,白磷在水下燃烧,该实验说明燃烧需要的条件为:①可燃物;②达到燃烧所需要的 ;③ 。
(4)图D所示实验观察到紫色小花变为红色,小花变红的原因是
(用化学方程式表示)。
请根据题目要求回答下列问题。
(1)使用托盘天平称未知某物品的质量正确操作顺序为(填序号) 。
①调游码 ②放称量纸 ③称量物放左盘
④调零点 ⑤加质量大的砝码 ⑥加质量小的砝码
A.①②③④⑤⑥B.④②③⑤⑥①C.④⑤⑥①②③
(2)在小烧杯中加入硫酸铜溶液后,加入铁钉,称量总质量为m1,反应发生了一段时间后,再称量小烧杯及烧杯内物质的总质量为m2,则(填“=”“>”“<”)m1 m2,从微观角度解释出现这种现象的原因 。
(3)如图装置中,称量小烧杯中所有物质的质量为m1,然后将小烧杯中的碳酸钠与盐酸完全混合,反应发生了一段时间后,再称量小烧杯及烧杯内物质的总质量为m2,则(填“=”“>”“<”)m1 m2,原因是: 。
水是宝贵的自然资源,是人类生命之源。
(1)下列各种水中,属于纯净物的是 (填字母)。
| A.汽水 | B.矿泉水 |
| C.蒸馏水 | D.经过净化处理的自来水 |
(2)自来水厂常用二氧化氯(ClO2)消毒,其中氯元素的化合价为 ;
(3)小刚为了净化收集到的雨水,自制了一个如图所示的简易净水器,其中小卵石、石英沙和膨松棉的作用是 。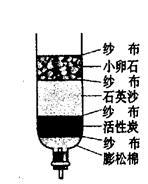
(4)自来水中含有少量Ca(HCO3)2等可溶性化合物,烧水时Ca(HCO3)2发生分解反应,生成难溶性的碳酸钙、水和二氧化碳,这就是壶中出现水垢的原因之一。请写出Ca(HCO3)2受热分解的化学方程式: 。
(5)今年“中国水周”的主题是“节约保护水资源,大力建设生态文明",请列举一条生活中你的节水做法: 。