下列各表述与示意图一致的是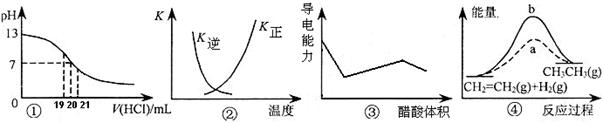
A 图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 KOH溶液,溶液的pH随加入酸体积的变化
B 图②中曲线表示反应N2(g)+3H2(g) 2NH3(g) ΔH < 0 正、逆反应的平衡常数K随温度的变化
2NH3(g) ΔH < 0 正、逆反应的平衡常数K随温度的变化
C 图③表示用醋酸滴定NaOH和氨水混合溶液时,溶液的导电能力随醋酸体积变化的曲线
D 图④中a、b曲线分别表示反应CH2=CH2(g)+ H2(g) → CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
下列有关物质性质比较正确的是
| A.密度:水>1—溴丙烷 | B.沸点:新戊烷>正戊烷 |
| C.羟基活性:酚羟基>醇羟基 | D.水中溶解度:乙酸乙酯>乙醇 |
下列化合物分子中,在核磁共振氢谱图中能给出三种信号峰的是
| A.CH3COOH | B.CH3COOCH2CH3 |
| C.CH3OH | D.CH3CH2OCH2CH3 |
下列物质中,属于芳香烃的是
A. |
B.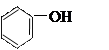 |
C.C2H6 | D.C2H5OH |
2010年诺贝尔物理学奖授予英国曼彻斯特大学的教授安德烈·海姆和康斯坦丁·诺沃肖洛夫,因两人在“研究二维材料石墨烯的开创性实验”中作出了突出的贡献。石墨烯是目前科技研究的热点,可看作将石墨的层状结构一层一层的剥开得到的单层碳原子。将氢气加入到石墨烯排列的六角晶格中可得最薄的导电材料石墨烷(如下图),下列说法中正确的是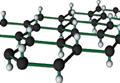
| A.石墨烯与石墨烷互为同系物 |
| B.石墨烯转变为石墨烷可看作取代反应 |
| C.石墨烯在氧气中完全燃烧,只产生二氧化碳气体。 |
| D.石墨烷的化学式通式是CnH2n+2 |
下列化学用语书写不正确的是
A.醛基官能团符号:—CHO  |
B.硝基苯的结构简式: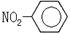 |
C.丙烷分子的球棍模型示意图: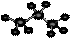 |
D.-OH与 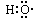 都表示羟基 都表示羟基 |