在不同条件下分别测得反应2SO2+O2 2SO3的化学反应速率,其中表示该反应进行的最快的是( )
2SO3的化学反应速率,其中表示该反应进行的最快的是( )
| A.v(SO2)=4 mol/(L·min) | B.v(O2)=3 mol/(L·min) |
| C.v(SO2)=0.1 mol/(L·s) | D.v(O2)=0.1 mol/(L·s) |
同温同压下两个容积相等的贮气瓶,一个装有NO气体,另一个装有O2和N2的混合气体,
则两瓶内的气体不一定相同的是()
| A.气体质量 | B.气体的物质的量 | C.分子总数 | D.原子数 |
25℃时,将0.1mol·L-1的某碱MOH溶液与某一元酸HA的溶液等体积混合,混合后的溶液恰好为中性。下列判断正确的是()
| A.HA溶液的pH值一定为1 | B.盐MA不能水解 |
| C.HA物质的量浓度一定为0.1 mol·L-1 | D.混合后的溶液中c(M+)一定等于c(A-) |
如右图所示,a、b是两根石墨棒,下列叙述正确的是( )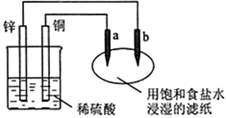
| A.a是正极,发生还原反应,b是阴极,发生还原反应 |
| B.装置工作时,稀硫酸溶液中C(H+)变小、C(Cu2+)变大 |
| C.往滤纸上滴加酚酞试液,a极附近颜色变红 |
| D.稀硫酸中硫酸根离子的物质的量不变 |
在下列各组离子中,能在同一溶液中大量共存的是()
| A.K+、AlO2-、SO42-、HCO3- | B.K+、H+、NO3-、Fe2+ |
| C.Na+、CO32-、Cl-、Ca2+ | D.Na+、Cl-、SO42-、H+ |
下列反应的离子方程式中正确的是()
| A.钠与水反应: Na+2H2O = Na+ +2OH-+H2↑ |
| B.氢氧化钡溶液和硫酸铵溶液混合:Ba2++SO42-= BaSO4↓ |
C.硫化钠溶于水呈碱性:S2-+ H2O 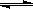 HS- + OH- HS- + OH- |
| D.向溴化亚铁溶液中通入少量氯气:Cl2+2Br-=2Cl-+Br2 |