汽车内燃机工作时产生的高温会引起N2和O2发生反应:N2(g)+O2(g) 2NO(g),这是汽车尾气中含有NO的原因之一。某同学为探究控制污染的方法,对该反应进行研究。
2NO(g),这是汽车尾气中含有NO的原因之一。某同学为探究控制污染的方法,对该反应进行研究。
(1)如图表示在T1、T2两种不同温度下,一定量的NO发生分解过程中N2的体积分数随时间变化的图象。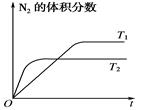
①达到平衡后反应速率v1(T1条件下)________v2(T2条件下)(填“>”、“<”或“=”)。
②N2(g)+O2(g) 2NO(g)为________(填“吸热”或“放热”)反应。
2NO(g)为________(填“吸热”或“放热”)反应。
(2)为避免汽车尾气中的有害气体对大气造成污染,应给汽车安装尾气净化装置。净化装置里装有含Pd等过渡元素的催化剂,写出CO、NO在催化剂作用下转化为无害气体的化学方程式:
乙偶姻是一种重要的香料。已知 乙偶姻中只含有C、H、O三种元素,其相对分子质量为88,分子中C、H、O原子个数比为2:4:1 。
乙偶姻中只含有C、H、O三种元素,其相对分子质量为88,分子中C、H、O原子个数比为2:4:1 。
请按要求回答下列问题:
Ⅰ.(1)乙偶姻的分子式为___________________。
(2)X是乙偶姻的同分异构体,且X属于酯类,其结构简式可能有__________种,
请写出X的一种结构简式:_________________________________________。
Ⅱ.与乙偶姻有关的反应如下:
(3)乙偶姻除含有碳氧双键外,还含有的官能团名称是____________________;
写出①、④的反应类型:① ___________、④ ___________;G的名称____________。
(4)A核磁共振氢谱仅有一种类型氢原子的吸收峰,其结构简 式是______________。
式是______________。
(5)写出②、③的化学反应方程式:
②________________________________________________________________ _____;
_____;
③_____________________________________________________________________;
(6)设计实验检验F中的官能团:
操作方法: ;
;
现象:
 ;
;
结论:。
Ⅰ.食品安全关系国计民生,影响食品安全的因素很多。
(1)聚偏二氯乙烯(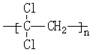 )具有超强阻隔性能,可作为保鲜食品的包装材料。它是由____________________(写结构简式)发生加聚反应生成的。
)具有超强阻隔性能,可作为保鲜食品的包装材料。它是由____________________(写结构简式)发生加聚反应生成的。
(2)劣质植物油中的亚油酸[CH3(CH2)4CH=CHCH2CH=C H(CH2)7COOH]含量很低。下列关于亚油酸的说法中,正确的是____________________________(填序号)。
H(CH2)7COOH]含量很低。下列关于亚油酸的说法中,正确的是____________________________(填序号)。
A.分子式为C18H34O2
B.一定条件下能与甘油(丙三醇)发生酯化反应
C.能和NaOH溶液反应
D.不能使酸性KMnO4溶液褪色
Ⅱ.香精(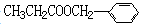 )在食品、药品、化妆品等方面应用广泛,用烷烃A合成香精及其它两种有机物的路线如下。
)在食品、药品、化妆品等方面应用广泛,用烷烃A合成香精及其它两种有机物的路线如下。
已知:A具有两种一氯代物B和C。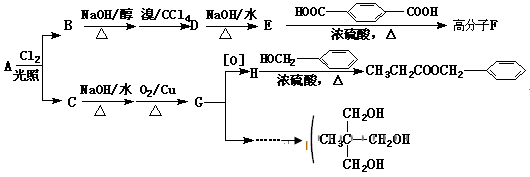
回答下列问题:
(1)和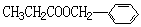 互为同分异构体的是____________________ (填序号)。
互为同分异构体的是____________________ (填序号)。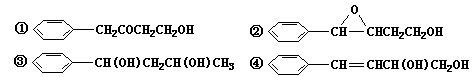
(2)D物质的名称为______________________________。
(3)高分子F的结构简式为___________ ___________________;
___________________;
(4)写出H和I反应生成三酯的化学方程式:______________________________。
下面表示的是某有机物烃A在一定条件下转化为H、I与N的关系,其中I与N是高分子。已知:


回答下列问题:
(1)写出反应类型:E→F ,G→R 。
(2)写出有机物的结构简式:F,B。
(3)写出下列化学方程式:
D与Cu(OH)2反应:。
R→N:。
G→I:。
(4)F也可以经一步反应后酸化生成R,其反应条件是:。
(5)E的同分异构体有多种,试写出其中属于苯的三取代物,满足结构为且 既能起银镜反应,遇FeCl3溶液又能呈紫色的同分异构体的结构简式。
既能起银镜反应,遇FeCl3溶液又能呈紫色的同分异构体的结构简式。
芳炔类大环化合物的研究发展十分迅速,具有不同分子结构和几何形状的这一类物质在高科技领域有着十分广泛的应用前景。合成芳炔类大环的一种方法是以苯乙炔
(CH≡C- )为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构为:
)为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构为:
(1)上述系列中第1种物质的分子式为。
(2)已知上述系列第1至第4种物质的分子直径在1~100nm之间,分别将它们溶解于有机溶刑中,形成的分散系为。
(3)以苯乙炔为基本原料,经过一定反应而得到最终产物。假设反应过程中原料无损失,理论上消耗苯乙炔与所得芳炔类大环化合物的质量比为。
(4)在实验中,制备上述系列化合物的原料苯乙炔可用苯乙烯(CH2=CH- )为起始物质,通过加成、消去反应制得。写出由苯乙烯制取苯乙炔的化学方程式(所需的
)为起始物质,通过加成、消去反应制得。写出由苯乙烯制取苯乙炔的化学方程式(所需的 无机试剂自选)
无机试剂自选)
在一定温度下将2 mol A和2 mol B两种气体混合于某2L密闭容器中,发生如下反应:3A(g)+B(g)  2C(g)+2D(g),2 min末反应达到
2C(g)+2D(g),2 min末反应达到 平衡状态,生成了0.8 mol D,请填写下列空白:
平衡状态,生成了0.8 mol D,请填写下列空白:
(1)2min内B的反应速率为_________________
(2)此温度下该反应的平衡常数K=_________________________
(3)如果缩小反应容器的体积,使压强增大,平衡体系中C的物质的量浓度_____________,C的质量分数___________,容器内气体的平均密度________________,平均相对分子质量________________。(填“增大”、“减小”或“不变”)
(4)如果上述反应在相同条件下从逆反应开始进行,开始加C和D各4/3 mol,要使平衡时各物质的物质的量与原平衡相等,则还应加入__________物质___________mol。