在一定条件下,将3molA 和1mol B 两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+ 2D(g)。2min末该反应达到平衡,生成0.8mol D ,并测得C的浓度为0.2mol·L-1。请填空:
xC(g)+ 2D(g)。2min末该反应达到平衡,生成0.8mol D ,并测得C的浓度为0.2mol·L-1。请填空:
(1)x=__________
(2)正反应是放热反应,则升高温度,正反应速率 ,逆反应速率 。(填升高、降低或不变)
(3)B的转化率为_________。
(4)能判断该反应达到平衡状态的依据是________(填字母)
| A.混合气体的密度不变 |
| B.容器中的压强不再变化 |
| C.生成D的反应速率是生成B的反应速率的2倍 |
| D.单位时间内生成3molA,同时生成1molB |
某学习小组共同学习乙醛的化学性质,以下是他们的学习过程,请填空:
(1)根据乙醛的结构对性质进行预测
| 乙醛的结构特点 |
可能的化学性质 |
有 双键,不饱和 双键,不饱和 |
与H2发生 反应,乙醛表现 性 |
 CHO中C-H键极性较强 CHO中C-H键极性较强 |
 CHO中C—H键被氧化,变为C—OH CHO中C—H键被氧化,变为C—OH |
(2)写出乙醛与氢气反应的方程式
(3)设计实验验证乙醛的还原性,请填全表格。
| 实验 |
现象 |
结论 |
| 取适量乙醛溶液,滴加高锰酸钾酸性溶液 |
|
乙醛能被高锰酸钾氧化 |
| 向新制银氨溶液中加入几滴乙醛溶液,水浴加热 |
试管壁上出现 |
乙醛将银氨溶液还原 |
| 向新制氢氧化铜悬浊液中加入适量乙醛溶液,加热 |
|
乙醛被氢氧化铜氧化 |
根据上表及所学知识回答:
①乙醛被高锰酸钾溶液氧化为 (填结构简式)
②写出乙醛发生银镜反应的方程式
(4)某有机物只含C、H、O三种元素,该有机物对氢气的相对密度为15,完全燃烧 0.1mol该有机物生成4.4gCO2和1.8gH2O,该有机物的分子式为 ,若红外光谱显示该分子中有醛基,则3g该物质与足量的新制氢氧化铜反应,生成沉淀的质量为 g
(1)根据官能团对下列有机物进行分类,将它们的类别填写在横线上。
(2)在①HC≡CH②C2H5Cl,③CH3CH2OH,④CH3COOH,⑤聚乙烯,⑥ 六种物质中:
六种物质中:
①能与溴水发生化学反应是________;②属于高分子化合物的是________;
③能与Na2CO3溶液反应的是________;④能发生酯化反应的是________;
⑤能发生消去反应的是。
(3)下图中A、B、C分别是三种有机物分子的表示方法: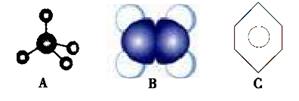
请回答下列问题:
①A、B两种模型分别是有机物的________模型和________模型。
②A、B、C三种有机物中,所有原子均共面的是________(填字母序号)。
③有机物C具有的结构或性质是________(填字母序号)。
a.是碳碳双键和碳碳单键交替的结构
b.有特殊气味、有毒、易溶于水、密度比水大
c.一定条件下能与液溴发生取代反应
d.能与浓硝酸发生氧化反应
利用废旧镀锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程图如下:
已知:Zn及其化合物的性质与Al及其化合物的性质相似。
回答下列问题:
(1)步骤I中所用的试剂是___________。
(2)步骤III中反应的离子方程式是__________________________________。
(3)步骤V可选用的试剂是_________(填序号)。
a.NaOH溶液b.氨水 c.盐酸
(4)步骤VI的实验操作是_____________。
处理SO2废气的一种工艺流程如下图所示: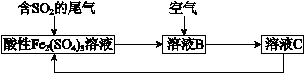
O2是氧化剂;(2)根据(1)的分析,得出:
根据流程,回答下列问题:
(1)溶液B与空气发生反应生成溶液C,其中氧化剂是________。
(2)SO2和酸性Fe2(SO4)3溶液反应的离子方程式是____________________________。
(3)推断Fe3+、O2和SO42−的氧化性由强到弱的顺序是_________________________。
过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。
(1)CaO2溶于盐酸可得H2O2,反应的化学方程式是 。
(2)CaO2在保存时要密封,避免接触水蒸气和二氧化碳。水蒸气与CaO2反应的化学方程式是 。
(3)已知:CaO2在350℃迅速分解生成CaO和O2。取某CaO2样品10 g(含有少量CaO杂质),充分加热后剩余固体的质量为8.4 g,则该样品中CaO2的质量分数为 。