(1)写出下列官能团的名称:
①—COOH ②—OH
(2)现有4种有机物:
①乙烯,②乙醇,③乙酸,④乙酸乙酯(填写结构简式):
②能发生水解反应的是 。
③具有酸性且能发生酯化反应的是 。
④能发生加成反应的是
化学在能源开发与利用中起着十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
I.氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行右图实验(图中所用电极均为惰性电极): 
(1)对于氢氧燃料电池中,下列表达不正确的是________
| A.a电极是负极,OH-移向负极 |
| B.b电极的电极反应为:O2+2H2O+4e-=4OH- |
C.电池总反应式为:2H2+O2 2H2O 2H2O |
| D.电解质溶液的pH保持不变 |
E.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(2)上图装置中盛有100mL、0.1mol·L—1AgNO3溶液,当氢氧燃料电池中消耗氢气112mL(标准状况下)时,则此时上图装置中溶液的pH=________(溶液体积变化忽略不计)
已知甲、乙、丙为常见的单质,A、B、C、D、X、Y、Z为常见化合物,且丙在常温常压下为气体,B为淡黄色固体,Y的摩尔质量数值比Z小16, B、X摩尔质量相同.各物质之间的转化关系如下图所示(各反应条件略).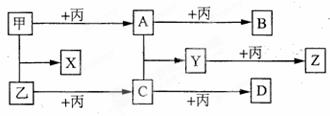
(1)乙位于周期表中_________ , 甲的最高价氧化物的水化物含有的化学键类型有_____________________.甲的氯化物晶体中的配位数是________
, 甲的最高价氧化物的水化物含有的化学键类型有_____________________.甲的氯化物晶体中的配位数是________
(2)将C通入溴水中,所发生反应的化学方程式是______;D属于_______晶体(填晶体类型).
(3)在101kPa时,4.0g乙在一定条件下与丙完全反应生成C,放出37kJ的热量,该反应的热 化学方程式是______________.
化学方程式是______________.
(4) 将B加入到Y的溶液中,其反应的离子方程式是_________________(产物仅限两种).
(5)比甲元素的原子序数少4的M元素,在一定条件下能与氢元素组成化合物MH5.已知MH5的结构与氯化铵相似,MH5与水作用有氢气生成,则MH5的电子式为_________(M要用元素符号表示).写出MH5与AlCl3溶液反应的化学方程式___________.
有一固体混合物X,可能含有氯化钠、碳酸钾、亚硝酸钠、硫酸铝、碱式碳酸镁、碳酸氢钠等物质。为探究X的成分,设计方案并进行了如下实验:
I.将X粉末充分加热,有气体产生。
Ⅱ.取一定量X粉末,加入足量的蒸馏水,粉末全部溶解, 得到无色溶液。
得到无色溶液。
Ⅲ.用铂丝蘸取少量Ⅱ中所得溶液,在火焰上灼烧,产生黄色火焰;透过蓝色钴玻璃观察,无紫色火焰。
Ⅳ.取Ⅱ中无色溶液,滴人KMnO4酸性溶液,紫红色不褪去。
V.取Ⅱ中溶液,用惰性电极电解,开始时阳极产生的气体能使
湿润的淀粉碘化钾试纸变蓝色。电解过程中测得溶液pH变化如
右图所示。
(1)根据实验Ⅳ可判断,一定不存在的物质是_________。
(2)X的成分是_________ (填化学式)。
(3)实验V中,0~t时间内,阴极的电极反应式为:_________电池总反应的离子方程式_________
(4)0→t1时间内,溶液pH升高比较缓慢的原因是:_________(用化学方程式表示)。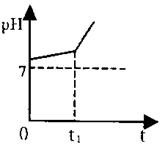
将煤气化转化成合成气,然后通过一碳化工路线合成各种油品和石化产品是一碳化工的极为重要的领域,具有广阔的前景,在未来相当一段时期将成为一碳化工的主要领域。除去水蒸气后的水煤气含55~59%的H2,15~18%的CO,11~13%的CO2,少量的H2S、CH4,除去H 2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成。
2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成。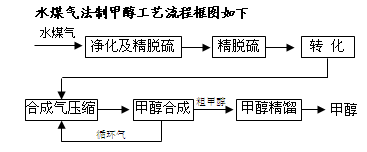
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g)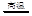 CO(g)+H2(g),此反应是吸热反应。①此反应的化学平衡常数表达式为;
CO(g)+H2(g),此反应是吸热反应。①此反应的化学平衡常数表达式为;
②下列能增大碳的转化率的 措施是;(填字母代号)
措施是;(填字母代号)
| A.加入C(s) | B.加入H2O(g) | C.升高温度 | D.增大压强 |
(2)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应如下: 2H2(g) + CO(g)  CH3OH(g);ΔH =-90.8kJ·mol-1,T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
CH3OH(g);ΔH =-90.8kJ·mol-1,T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
| 物质 |
H2 |
CO |
CH3OH |
| 浓度/(mol·L-1) |
0.2 |
0.1 |
0.4[ |
①比较此时正、逆反应速率的大小:v正v逆(填“>”、“<”或“=”)。
②若加入CO、H2后,在T5℃反应10min达到平衡,c(H2)=0.4 mol·L-1,则该时间内反应速率v(CH3OH) =mol-1·(Lmin)-1。
(3)生产过程中,合成气要进行循环,其目的是 。
。
最近 科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇(分子式为CH3OH)。“绿色自由”构想技术流程如下:
科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇(分子式为CH3OH)。“绿色自由”构想技术流程如下: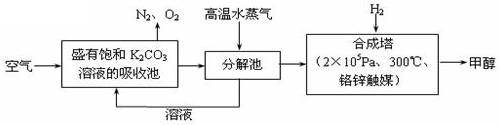
(1)在合成塔中,若有2.2kgCO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出2473.5kJ的热量,试写出合成塔中发生反应的热化学方程式。
(2)①上述合成反应具有一定的可逆性,从平衡移动原理分析,低温有利于原料气的转化,而实际生产中采用300°C的温度,其原因是。
②“绿色自由”构想技术流程中常包括物质和能量的“循环利用”,上述流程中能体现“循环利用”的除碳酸钾溶液外,还包括。
③下列措施中能使n(CH3OH)/n(CO2)增大的是___________。 (填字母代号)
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1mol CO2和3mol H2 |
(3)甲醇可制作燃料电池。写出以氢氧化钾为电解质的甲醇燃料电池负极反应式。当电子转移的物质的量为时,参加反应的氧气的体积是6.72L(标准状况下)。